Khí metan là một trong những loại khí không còn xa lạ trong chương trình hóa học rộng lớn và có tương đối nhiều ứng dụng trong cuộc sống thường ngày hàng ngày. Vậy khí metan là gì? cách làm hóa học của nó ra sao? cùng nó bao gồm phản ứng sệt trưng cũng như ứng dụng gì? Hãy cũng DINHNGHIA.COM.VN tra cứu câu vấn đáp khí metan là gì thông qua nội dung bài viết dưới phía trên nhé.
Bạn đang xem: Công thức hóa học của khí metan là
Khí metan là gì? phương pháp hóa học và nguồn gốc của khí metan
Phản ứng đặc trưng và đặc thù hóa học của metan
Khí metan là gì? phương pháp hóa học và xuất phát của khí metan
Khí metan là gì? phương pháp hóa học của khí metan
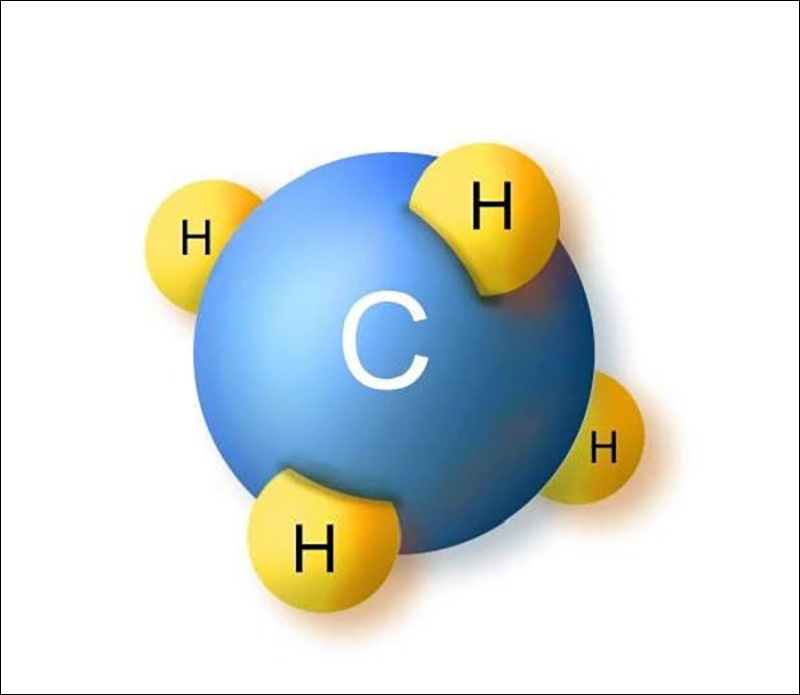
Khí metan là trong những loại khí thuộc dãy đồng đẳng ankan, sát bên các khí như etan, propan, butan… Đây là hydrocacbon đơn giản dễ dàng nhất với công thức hóa học là CH4. Vậy khí metan kí hiệu là gì? phụ thuộc vào công thức hóa học, ta có thể dễ dàng thấy được, khí metan được kí hiệu là CH4 với cấu trúc từ 1 nguyên tử Cacbon cùng 4 nguyên tử Hidro. Ta có thể biểu diễn khí mê tan như sau:
H
|
H – C – H
|
H
Khí metan hiện ra từ đâu?
Đây là một trong loại khí ko màu, không vị với không mùi lúc ở điều kiện tiêu chuẩn. Với đặc biệt, khí metan rất dễ dàng cháy. Với điểm sáng như vậy, khí metan sinh ra từ đâu?
Khí metan được ra đời từ quy trình sinh học quen thuộc như trường đoản cú sự men hóa trong mặt đường ruột của các loài đụng vật, sự phân giải kị khí của đất khi ở điều kiện ngập nước… Đồng thời, khí metan cũng khá được tạo ra từ đầy đủ cơ cháy rừng hay các phản ứng đốt nguyên liệu hóa thạch.
Đặc biệt, đó là một trong những thành phần chính của khí trường đoản cú nhiên, khí dầu mỏ… vì thế, nó được tạo ra từ các phản ứng trong quá trình chế vươn lên là dầu mỏ cùng chưng đựng than đá.

Phản ứng đặc trưng và tính chất hóa học của metan
Ở phần đầu tiên, ta đã khám phá metan là gì, tương tự như công thức chất hóa học của nó, và cũng đã biết công thức kết cấu của metan chỉ có những liên kết đơn giữa Cacbon cùng Hidro. Bởi đó, metan sẽ có được những bội phản ứng đặc thù và có đặc thù hóa học riêng. Vậy hồ hết phản ứng đặc trưng của metan là gì?
Khí metan chức năng với oxi
Khí metan khi tính năng với oxi được call là các phản ứng cháy, thành phầm được tạo ra sau bội nghịch ứng này là khí Cacbonic cùng nước. Sự đốt cháy metan hay nói một cách khác là phản ứng sức nóng phân oxy hóa.
(CH_4 + 2O_2 rightarrow CO_2 + 2H_2O)
Khí metan chức năng với clo
Khi gồm ánh sáng, khí metan sẽ xảy ra phản ứng nuốm với clo để tạo thành metyl clorua bao gồm công thức (CH_3Cl).
(CH_4 + Cl_2 rightarrow CH_3Cl + HCl) (khí)
Tiếp tục phản bội ứng với clo, ta đang thu được sản phẩm sau cuối là metyl halogic và axit halogenic. Đây là phản ứng nhiều giai đoạn và được nghe biết với tên thường gọi là phản ứng Halogen.
Phản ứng phân hủy
Tại đk nhiệt độ cao, khí metan hoàn toàn có thể bị phân diệt để tạo ra Cacbon và latex>H_2.
Cụ thể: (CH_4 rightarrow C + 2H_2)
Khi tính năng với khí Clo ở điều kiện nhiệt chiều cao (hay lúc bị đun nóng), phản bội ứng phân bỏ metan sẽ khởi tạo ra muội than cùng axit.
(CH_4 + 2Cl_2 rightarrow C + 4HCl)
Phản ứng pha chế khí metan
Có hết sức nhiều phương pháp để điều chế khi metan trong tự nhiên và thoải mái và trong chống thí nghiệm. Trong bài viết hôm nay, bọn họ sẽ tò mò 6 cách đơn giản nhất cùng được áp dụng phổ biến nhất hiện nay nhé.
Điều chế từ nhôm cacbua: (Al_4C_3 + 12H_2O rightarrow 4Al(OH)_3 + 3CH_4) (khí). Bên cạnh HCl, ta cũng có thể sử dụng nước để cụ thế.Phản ứng vôi tôi xút với CaO ở đk nhiệt độ cao:
(CH3 – COONa + Na
OH rightarrow Na_2CO_3 + CH_4) ↑
Ứng dụng của metan
Sau khi đã khám phá khí metan là gì, cũng như những phản ứng hóa học đặc thù của nó, họ hãy cùng khám phá về ứng dụng của một số loại khí này nhé.
Khí metan là một trong những nguyên liệu quan tiền trọng, được sử dụng để sưởi ấm và nấu ăn ăn. Vày so cùng với than đá, loại khí nhiên này tỏa ra nhiều nhiệt và sinh ra ít CO2 hơn. ở kề bên đó, khí metan còn được dùng trong công nghiệp để cung cấp Hydro, methanol, axit axetic hay anhydrit axetat.
Đây là hai ứng dụng thông dụng và quan trọng nhất của metan trong cuộc sống thường ngày và trong công nghiệp. Mặc dù nhiên, khí metan vẫn đang còn những tác động nhất định tới sức khỏe con người, vị thế chúng ta cần sử dụng loại khí này hợp lý và đúng cách.

Vậy là bọn họ đã tìm hiểu chấm dứt về khí metan rồi. Hy vọng qua bài viết này, bọn họ đã phát âm được khí metan là gì, tương tự như những bội nghịch ứng hóa học đặc trưng và vận dụng của nó. Ví như như có bất kỳ thắc mắc nào nội dung bài viết khí metan là gì, hãy để lại nhận xét dưới đây, họ sẽ thuộc nhau dàn xếp và mày mò nhé.
Leave a Reply Cancel reply
Your email address will not be published. Required fields are marked *
Khí metan (CH4) chắc đã không còn là cái thương hiệu xa lạ đối với cả mọi người. Núm nhưng toàn bộ mọi bạn đã làm rõ gì về khí Metan cũng tương tự công dụng, tính năng của chúng đối với đời sống con tín đồ chưa? các bạn cũng sẽ bất thần khi khí Metan chưa hẳn ở đâu xa, mà chính là những vật tư có trong mái ấm gia đình chúng ta.
Khí Metan là gì?
Khí metan (methane) giỏi còn có tên gọi khác là khí bùn ao, được kí hiệu là CH4 vào hóa học.
Là một hidrocacbon phía trong dãy đồng đẳng akan. Bọn chúng là thành phần chủ yếu của khí dầu mỏ, gồm trong thoải mái và tự nhiên khá nhiều. Metan được tạo nên trong quá trình chế biến, chưng đựng hay cung ứng khí dầu mỏ. Bởi vì vậy nó cũng xuất hiện trong gia đình của chúng ta vì nó có trong số bình gas.
Tính chất vật lí của CH4:
Meta là hóa học khí không màu ko mùi, không vị. Chúng rất độc với dễ bắt cháy, tạo nên lửa màu sắc xanh.CH4 hóa lỏng lúc ở −162 °C, hóa rắn ở −183 °CĐiểm bốc cháy là 537 °CKhối lượng riêng rẽ của metan là 0.717 kg/m3Metan không tồn tại khả năn hòa tan trong những dung môi phân cực vì không có sư liên kết giữa những hidro, bọn chúng chỉ tung trong dung môi không phân cực.CH4 không tồn tại tính dẫn điện.Muốn xem Tổng Hợp một vài đồ Án – Giáo Trình xử lý Khí Thải- giải pháp xử lý Khí SO2 —> Hãy truy vấn Vào links sau Để DOWNLOAD
https://giaoducq1.edu.vn/tong-hop-bo-do-an-xu-ly-khi-thai-link-google-driver/
Tính hóa chất của CH4
Công thức cấu tạo Của CH4
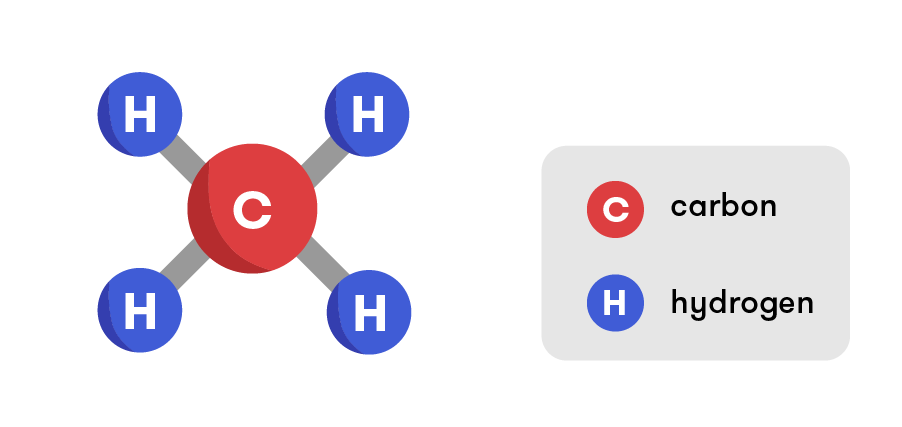
Metan hoàn toàn có thể tham gia vào một vài phản ứng chất hóa học như:
Phản ứng cầm cố với halogen clo, bromMêtan bội nghịch ứng với Halogen đã tạo ra dẫn xuất halogen với hidro halogenua.
Ví dụ đối với Cl: Metan làm phản ứng với Clo trong ánh sáng khuếch tán theo không ít giai đoạn:
CH4 + Cl2 → CH3Cl + HClCH3Cl + Cl2 → CH2Cl2 + HCl
CH2Cl2 + Cl2 → CHCl3 + HCl
CHCl3 + Cl2 → CCl4 + HCl
Phản ứng với khá nước sinh sản khí CO
CH4 + H2O = teo + H2O
Điều khiếu nại phản ứng: nhiệt độ 1000, hóa học xúc tác Ni
Phản ứng cháy với oxiPhản ứng cháy hoàn toàn:
CH4 + 2O2 → CO2 + 2H2O + Q
Q= −891 k
J/mol sinh hoạt 25o
C, 1 atm
Phản ứng cháy không hoàn toàn: Được sử dụng trong chế tạo fomanđehit, bột than, khí đốt,…



Metan bị nhiệt độ phân bằng phương pháp nung nóng nhanh metan với một lượng nhỏ oxi ở nhiệt độ khoảng 1500o
C:

J/mol)
Oxi được dùng làm đốt cháy một phần metan, cung ứng thêm nhiệt cho phản ứng.
Ứng dụng của Metan so với đời sống bé người
Metan được áp dụng vào cuộc sống sinh hoạt và sản xuất của con ngời rất nhiều, có thể kể cho như:
Ứng dụng CH4 làm các nhiên liệu:
CH4 cũng chính là một nhiên liệu không thể thiếu trong đời sống, quan trọng đặc biệt có vào khí gas. Nấu bởi khí gas, đồ sưởi ấm giúp bạn giảm sút lượng thải CO, CO2 ra ngoài không khí thay vì dùng bởi than, củi.
Ứng dụng CH4 vào công nghiệp:
Metan tương đối “ tích cực và lành mạnh “ trong số phản ứng hóa học ở nhiều dạng không giống nhau: rắn, lỏng, khí. Trong những ngành công nghiệp hóa học, metan là nguyên liệu tạo ra một số trong những chất như hydro, methanol, axit axetic và anhydrit axetic.

Vậy chúng ta có biết Metan có ở chỗ nào trong tự nhiên và thoải mái không?
Metan rất có thể xuất hiện từ những khí thải của sự việc đốt cháy nguyên nhiên liệu hóa thạch, cháy rừng cũng ko ngoại lệ.CH4 có trong quy trình sinh học có trong ruột của cồn vật, tiêu biểu là sự men hóa trong đường ruột, bao tử của động vật nhai lại.Có vào sự phân hủy kị khí ở số đông nơi ao hồ, váy đầm lầy, trầm tích dưới đáy biển… dưới hầm cầu chúng cũng lộ diện vì sự lên men yếm khí.CH4 là trong những thành phần chính của khí từ nhiên, đặc biệt là khí dầu mỏ, chính vì thế chúng rất dễ bắt cháy.Một điểm quánh biệt xem xét là metan có rất nhiều ở trong số những hang động, đá giếng sâu. Chính vì vậy tuyệt đối không tự ý đi xuống dưới giếng, hố sâu khi không được sẵn sàng kĩ càng. Muốn xuống giếng sâu đề xuất mang đồ bảo lãnh và phương diện nạ chống độc. Đặc biệt hơn tuyệt vời không được có theo bất cứ vật dụng, vật tư nào dù kích nổ, bắt cháy ở tầm mức độ nào. Chỉ cần bạn áp dụng một ngọn lửa rất bé dại nhưng trong môi trường đựng nhiều Metan cũng gây cháy lớn, tiếng nổ và bị tiêu diệt người.Khí Metan tuy ko độc trực tiếp dẫu vậy cũng gây nguy hại cho con bạn như: dễ dàng bắt cháy tạo nổ, tích tụ vô số sẽ tạo ngạt thở, bên cạnh đó còn có tác dụng gây lây nhiễm độc khí CO.Metan còn là một trong những chất tạo cho hiện tượng hiệu ứng nhà kính, nóng lên toàn cầu. Nó có ở trong khí quyển Trái Đất tuy vậy không đáng kể. Mật độ Metan còn biến đổi theo mùa, tuy nhiên hiện nay nó vẫn vẫn có chiều hướng tăng.Xem thêm: Cách xác định công thức hóa học của hợp chất, lý thuyết công thức hóa học
Hi vọng qua nội dung bài viết trên hoàn toàn có thể giúp ích cho những người đọc những thông tin về khí Metan. Hầu như ứng dụng cũng giống như nguy hiểm mà lại Metan gây ra để phòng kị kịp thời.