Axit nitric là gì?
Axit nitric là gì?
Axit nitric là một hợp hóa học vô cơ dễ ăn mòn, dễ khiến cho cháy cùng khi sống dạng tinh khiết, nó tồn tại ở dạng lỏng, không màu và bốc khói mạnh nếu gặp điều kiện không gian ẩm. Tùy từng lượng nito dioxide cơ mà khói axit đang có white color hoặc color đỏ. Nếu để lâu, axit nitric sẽ đưa sang màu vàng vị sự tụ tập của nito oxide NOx.
Bạn đang xem: Công thức hóa học của axit nitric là
Sự tổng hòa hợp axit nitric đã làm được ghi nhận lần thứ nhất vào khoảng tầm năm 800 AD bởi Jabir ibn Hayyan - một nhà giả kim người Ả Rập.

Jabir ibn Hayyan - một nhà giả kim người Ả Rập đã tổng hợp thành công xuất sắc axit HNO3
Trong tự nhiên, axit nitric sinh ra trong mưa giông gồm kèm theo sấm chớp và hiện nay, nó là trong số những tác nhân gây nên những cơn mưa axit.

Axit nitric sinh ra trong mưa giông bao gồm kèm theo sấm chớp
Công thức cấu tạo của axit nitric
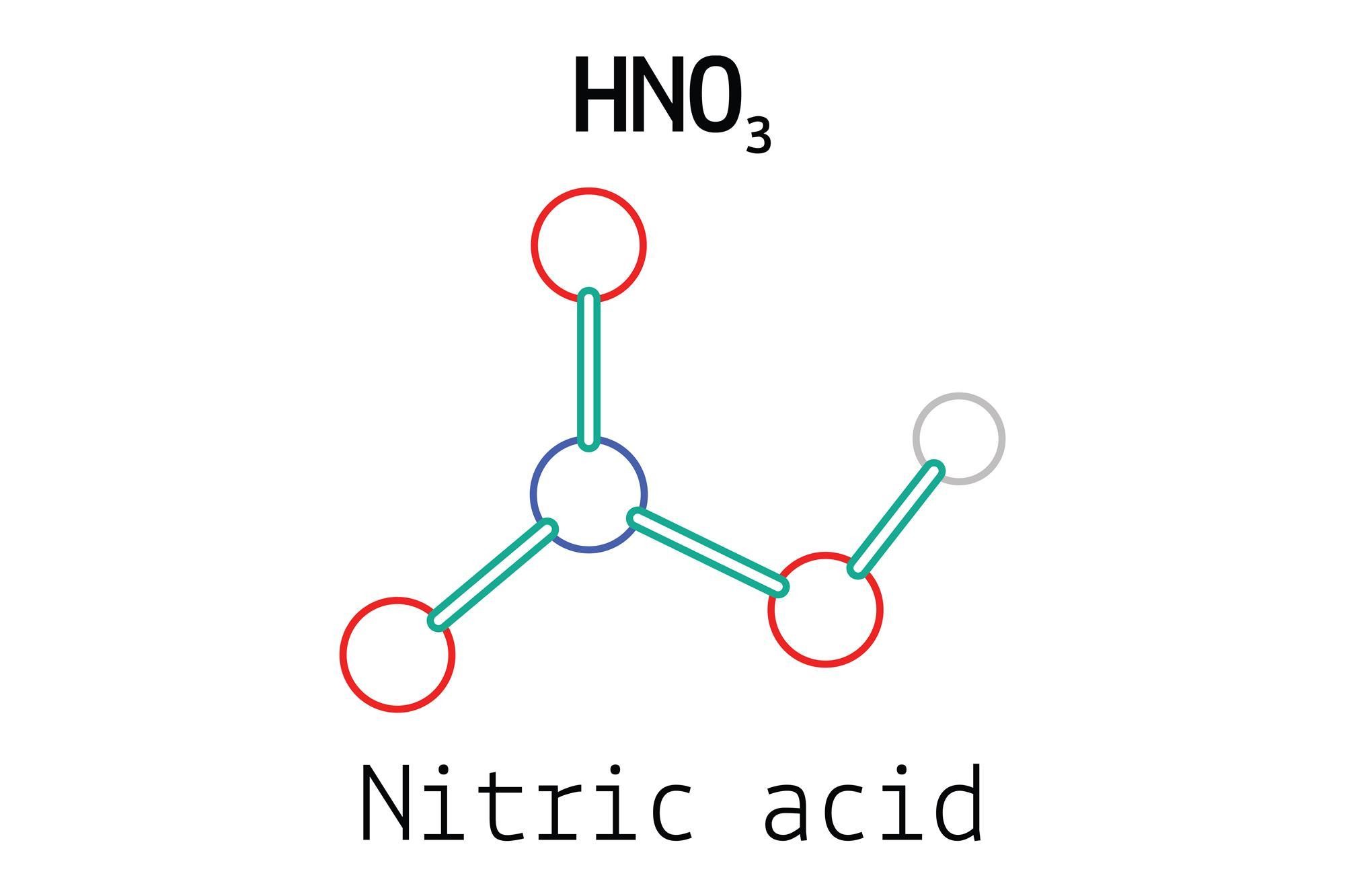
Công thức axit nitric là HNO3 với công thức cấu tạo của nó là:
Công thức axit nitric là HNO3
Trong hợp hóa học HNO3, yếu tố N tất cả số oxi hóa tối đa là +5.
Tính chất đặc trưng của axit nitric
Tính chất vật lý
- Axit nitric khan tinh khiết là 1 trong chất lỏng bao gồm tỷ trọng khoảng 1522 kg/m³, đông đặc để hiện ra nên những tinh thể white ở ánh sáng - 42 ℃ cùng sôi ở 83 ℃. Khi sôi vào ánh sáng, bao gồm cả trong điều kiện nhiệt độ phòng, một trong những phần HNO3 sẽ bị phân diệt thành nito dioxide. Phương trình phản ứng xảy ra như sau:
4HNO3 → 2H2O + 4NO2 + O2 (72 ℃)
Điều này đồng nghĩa với việc cần bảo vệ acid nitric khan ở nhiệt độ dưới 0 ℃ nhằm tránh bị phân hủy.
- Nito dioxide kết hợp trong axit nitric tạo thành dung dịch có màu rubi hoặc đỏ (khi ở ánh nắng mặt trời cao hơn).
- Axit nitric tinh khiết khi đặt ra không khí có xu hướng bốc khói trắng còn axit cùng với NO2 bốc khói khá màu nâu khá đỏ.

Axit nitric tinh khiết lúc đặt ra không gian có xu thế bốc sương trắng

Axit với NO2 bốc khói tương đối màu nâu tương đối đỏ
- hoàn toàn có thể pha trộn HNO3 với nước theo bất kỳ tỷ lệ nào với khi chưng cất, nó sẽ tạo ra một azeotrope có độ đậm đặc HNO3 là 68%. Azeotrope này có nhiệt độ sôi là 120,5 ℃ tại áp suất 1 atm. Tất cả 2 hydrat hay được nói tới, đó đó là trihydrat (HNO3·3H2O) và monohydrat (HNO3·H2O).
- NOx tan trong axit nitric và điều đó cũng gây nên ít nhiều tác động đến các tính chất vật lý liên quan đến nồng độ của những oxide này, đa phần là áp suất khá trên chất lỏng, ánh sáng sôi và màu sắc.
- HNO3 bị phân hủy khi chạm chán nhiệt độ dài hoặc bị ánh sáng chiếu vào với mật độ tăng lên.
Tính hóa chất của Axit Nitric HNO3
Tính chất hóa học của HNO3 là gì
Axit nitric là 1 dung dịch nitrat hidro và là 1 trong những axit khan, một monoaxit bạo gan với tính oxy hóa mạnh. Nó rất có thể nitrat hóa những hợp chất vô cơ và bao gồm hằng số cân bằng axit (p
Ka) là −2. Dường như thì axit nitric cũng là một trong những monoproton chỉ gồm một sự phân ly nên những khi ở trong dung dịch, nó bị năng lượng điện ly hoàn toàn thành một proton hydrat (ion hidroni) và những ion nitrat NO3−.
HNO3 + H3O+ H2O → H3O+ + NO3-
Axit nitric là một trong những axit mạnh
- HNO3 có công dụng làm giấy quỳ gửi thành màu đỏ.
- chức năng với oxit bazo, bazo mà khi sống trong oxit, bazo tương ứng, kim loại đã đạt hóa trị cao nhất để sản xuất thành muối cùng nước:
Cu
O + 2HNO3 → Cu(NO3)2 + H2O
Mg(OH)2 + 2HNO3 → Mg(NO3)2 + 2H2O
- công dụng với muối mà khi sống trong muối hạt đó, kim loại đã đoạt hóa trị cao nhất để chế tạo ra thành muối mới và axit mới:
Ca
CO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O
Axit nitric là chất oxi hóa mạnh
- tác dụng với kim loại:
Axit nitric phản nghịch ứng với số đông các kim loại bỏ vàng cùng Platin để sản xuất thành muối nitrat, nước và thành phầm khử của N+5 (NO, N2O, NO2, N2 cùng NH4NO3).
Nếu axit đặc cùng nóng thì sản phẩm tạo ra là NO2Nếu axit loãng thì thành phầm tạo ra thường xuyên là NONếu hóa học khử bạo gan và trong điều kiện nồng độ axit với nhiệt độ tương thích thì sản phẩm tạo ra có thể là N2O, N2, NH4NO3.HNO3 + M → M(NO3)n + H2O + NO2 (NO, N2O, N2, NH4NO3)
Cụ thể như sau:
HNO3 đặc, nóng + sắt kẽm kim loại → muối hạt nitrat + NO + H2OHNO3 loãng + kim loại → muối bột nitrat + NO + H2OHNO3 loãng lạnh + kim loại → muối nitrat + H2Mg(rắn) + 2HNO3 loãng lạnh → Mg(NO3)2 + H2 (khí)Sản phẩm khử của N+5 phụ thuộc vào độ táo bạo yếu của kim loại tương tự như nồng độ của hỗn hợp axit. Thường thì hỗn hợp HNO3 đặc sẽ khởi tạo ra khí NO2 còn hỗn hợp loãng tạo ra khí NO. Hỗn hợp HNO3 càng loãng cùng kim loại chức năng càng táo tợn thì N càng bị khử xuống đến mức sâu hơn.
Ví dụ như: 4HNO3 + Cu→ Cu(NO3)2 + 2NO2 + 2H2O

HNO3 phản bội ứng mãnh liệt với đồng
4HNO3 loãng + sắt → Fe(NO3)3 + NO + 2H2O
10HNO3 + 8Na → 8Na
NO3 + NH4NO3 + 3H2O
Chú ý: Nếu mang lại sắt hoặc tất cả hổn hợp sắt và đồng công dụng với dung dịch axit nitric cơ mà sau phản nghịch ứng còn dư kim loại thì trong dung dịch sắt thu được vẫn chỉ tất cả muối ngơi nghỉ dạng Fe2+.
- tính năng với phi kim:
HNO3 đặc tính năng với phi kim (các yếu tắc á kim, trừ silic cùng halogen) sẽ tạo ra khí NO2, nước cùng oxit của phi kim.
4HNO3 sệt + C → 4NO2 + 2H2O + CO2
5HNO3 sệt + p → 5NO2 + H2O + H3PO4
4HNO3 loãng + 3C → 3CO2 + 4NO + 2H2O
- công dụng với những chất khử khác như oxit bazo, bazo, muối mà lại khi sống trong oxit bazo, bazo, muối hạt đó, kim loại chưa tồn tại hóa trị cao nhất.
Fe
O + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
Fe
CO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
- phản ứng với hòa hợp chất:
2HNO3 (>5%) + 3H2S → 3S + 2NO + 4H2O
8HNO3 đặc + Pb
S → Pb
SO4 + 8NO2 + 4H2O
Bạc(I) photphat - Ag3PO4 tan vào HNO3 còn thủy ngân(II) sulfide - Hg
S không công dụng với HNO3.
- tính năng với những hợp chất hữu cơ: Axit HNO3 có chức năng phá bỏ nhiều một số loại hợp chất hữu cơ nên nếu để axit này xúc tiếp với khung người thì sẽ tương đối nguy hiểm.

Axit HNO3 có chức năng phá diệt nhiều loại hợp chất hữu cơ
Chú ý:
- một trong những kim các loại như sắt, nhôm, crom không tan trong axit nitric đặc, nguội do nó đã biết thành thụ cồn hóa vày khi tính năng với axit này, một lớp màng oxit mỏng dính đã được hình thành, ngăn không cho các phản ứng tiếp theo có thể xảy ra.
- Trong một trong những bài toán về axit HNO3, bạn giải bài bác tập phải chăm chú biện luận mang lại trường hợp tạo nên các sản phẩm khác như NH4NO3 dựa theo phương pháp bảo toàn e (nếu số mol e cho to hơn số mol e nhấn để chế tác khí) hoặc phụ thuộc những dữ kiện gồm trong đề bài bác (chẳng hạn đến dung dịch xút vào dung dịch sau phản bội ứng thì bao gồm khí thoát ra) hoặc những hợp chất khí của N nhờ vào tỷ khối khá của tất cả hổn hợp đã cho.
- khi axit nitric tác bazo cùng oxit bazo thì tính khử chỉ xảy ra khi bội nghịch ứng trung hòa.
- Với phần lớn kim loại có nhiều hóa trị như sắt cùng crom thì nếu dùng dư axit sẽ khởi tạo muối của sắt kẽm kim loại có hóa trị 3 (Fe3+, Cr3+) còn nếu cần sử dụng thiếu axit cùng dư kim loại thì sẽ tạo muối sắt kẽm kim loại hóa trị 2 (Fe2+, Cr2+) hoặc hoàn toàn có thể tạo ra đồng thời cả hai loại muối.
- Trong môi trường xung quanh axit, các chất khử phản bội ứng với muối bột NO3- cũng tương tự như bội nghịch ứng với HNO3. Bởi đó chúng ta chỉ cần vồ cập đến bản chất của làm phản ứng là phương trình ion.
Điều chế axit nitric HNO3 có các phương pháp nào?
Phương pháp cung ứng HNO3 vào công nghiệp
Axit nitric được điều chế bằng phương pháp pha trộn nito dioxide và nước với oxy hoặc áp dụng không khí để oxy hóa axit nitro. Làm phản ứng xảy ra theo phương trình:
4NO2 + O2 + 2H2O → 4HNO3
Axit nitric loãng hoàn toàn có thể cô đặc mang lại nồng độ 68% cùng với một lếu láo hợp azeotropic 32% nước. Việc cô quánh này được thực hiện bằng cách chưng cất axit HNO3 loãng với axit sunfuric (vai trò của H2SO4 là chất khử nước). Trong bài bản phòng thí nghiệm, hy vọng cô sệt HNO3 theo cách này thì yêu cầu dùng các dụng cố kỉnh thủy tinh với chưng cất với áp suất thấp nhằm tránh vấn đề axit bị phân hủy. Xem xét tránh các mối nối bằng thủy tinh và nút bựa vì HNO3 có thể tấn công.
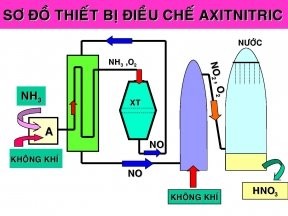
Phương pháp phân phối HNO3 vào công nghiệp
Dung dịch HNO3 cấp thương mại thường có nồng độ là 52% cùng 68%. Việc sản xuất axit nitric này thường xuyên sử dụng công nghệ Ostwald do Wilhelm Ostwald phát minh ra.
Ngoài ra, HNO3 cũng rất có thể được tổng hợp bằng cách oxi hóa amonia, tuy vậy sản phẩm đang bị pha loãng bởi nước vày phản ứng tạo thành ra. Mặc dù thế thì phương pháp này cũng khá quan trọng trong câu hỏi sản xuất amoni nitrat từ amoniac theo công nghệ Haber vì thành phầm cuối cùng có thể sản xuất từ nguyên liệu đầu vào đó là nito, hidro cùng oxy.
Điều chế axit nitric trong chống thí nghiệm
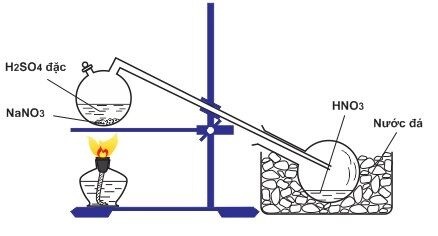
Điều chế axit nitric trong phòng thí nghiệm
Trong chống thí nghiệm, axit HNO3 được điều chế bằng cách cho Cu
NO3 hoặc mang đến KNO3 phản ứng cùng với H2SO4 96% theo khối lượng bằng nhau, tiếp nối chưng cất hỗn phù hợp này ở ánh sáng sôi 83 ℃ cho tới khi chỉ với lại hóa học kết tinh màu trắng và kali bisunfat còn gìn giữ trong bình.
Khi thực hiện thí nghiệm thì cần được dùng những trang thiết bị bằng thủy tinh, rất tốt là bình cổ cong nguyên khối bởi vì axit nitric khan tiến công cả nút bần, da và cao su đặc nên sự rò rỉ rất có thể sẽ khôn xiết nguy hiểm.
KNO3 + H2SO4 → KHSO4 + HNO3
NOx hòa rã được một số loại bỏ bằng cách giảm áp suất tại nhiệt độ phòng từ 10 – nửa tiếng với áp suất 200 mm
Hg (27 k
Pa).
Ứng dụng axit nitric HNO3

Một số áp dụng của axit nitric
1. Trong phòng thí nghiệm
- Axit HNO3 là thuốc demo chính được dùng cho quy trình nitrat hóa cùng nó cũng hay được áp dụng với vai trò là 1 trong những tác nhân lão hóa mạnh.
- Dùng trong các thí nghiệm tương quan đến vấn đề thử clorit: mang đến axit HNO3 vào chủng loại thử, tiếp đến thêm hỗn hợp Ag
NO3 vào. Bội nghịch ứng sẽ tạo nên ra kết tủa white của tệ bạc clorua.
2. Trong công nghiệp
- Axit nitric nồng độ 68% được thực hiện để chế tạo thuốc nổ bao gồm trinitrotoluen (TNT) với cyclotrimethylenetrinitramin (RDX) cùng nitroglycerin.
- Axit nitric có nồng độ 0,5 - 2% được sử dụng làm hợp chất nền để khẳng định xem trong dung dịch có tồn tại sắt kẽm kim loại không. Cách thực hiện axit HNO3 đến trường phù hợp này được hotline là nghệ thuật ICP-MS và ICP-AES.
- thực hiện trong ngành xi mạ, luyện kim và tinh lọc: cho HNO3 tính năng với HCl, ta thu được hỗn hợp nước cường toan có khả năng hòa rã vàng cùng bạch kim.

Nước cường toan được pha trộn từ axit nitric đậm đặc với axit clohydric
- dùng để sản xuất những chất hữu cơ, dung dịch nhuộm vải, bột màu, tô và thuốc tẩy màu.
- dùng để sản xuất nitrobenzen, một tiền chất để chế tạo anilin và những dẫn xuất anilin với rất nhiều ứng dụng quan trọng đặc biệt trong chế tạo dược phẩm, bọt bong bóng xốp polyuretan và sợi aramit.
- HNO3 tất cả nồng độ thấp, khoảng chừng 10% thường được dùng để tạo ra màu kim cương xám khôn cùng giống với màu gỗ cũ hoặc gỗ thành phẩm.
- Là hợp hóa học trung gian dùng làm sản xuất bong bóng xốp polyuretan mềm cùng các sản phẩm polyuretan tự nguyên liệu toluen diisoxyanat, lấy ví dụ như như các chất kết dính, chất bịt kín, chất bọc phủ cùng chất bầy hồi.
- sử dụng làm hóa học tẩy rửa bề mặt kim nhiều loại và những đường ống dẫn trong các nhà lắp thêm sữa.

Dùng làm chất tẩy rửa bề mặt kim loại
- loại trừ các tạp hóa học và cân đối lại độ tiêu chuẩn chỉnh của nước.
- áp dụng axit nitric trong tiếp tế phân bón, hầu hết là phân phối phân đạm và các muối nitrate ngành phân bón như Ca(NO3)2 hoặc KNO3…
- giữa những ứng dụng cho axit nitric bốc sương trắng IWFNA, đó là sử dụng làm chất oxi hóa trong nhiên liệu lỏng tên lửa.
- ngoài ra thì axit HNO3 cũng được sử dụng làm hóa học thử màu sắc (colorometric test) nhằm phân biệt heroin và morphine.
Axit nitric có gian nguy không
- Axit nitric là một chất oxy hóa mạnh. Lúc phản ứng với những hợp hóa học như carbide, cyanide cùng bột sắt kẽm kim loại thì nó rất có thể tạo thành một tất cả hổn hợp gây nổ. Axit nitric cũng làm phản ứng khôn xiết mãnh liệt với khá nhiều hợp hóa học vô cơ như turpentine và tự bốc cháy.
- Nếu nhằm axit HNO3 đặc bắn lên domain authority thì vùng da đó sẽ chuyển sang color vàng do phản ứng với protein keratin. Nếu như được trung hòa thì vết màu quà này sẽ gửi sang màu cam.
- phản ứng to gan lớn mật với các kim các loại và ra đời khí hidro rất dễ khiến cháy trong ko khí.
Các giải pháp xử lý lúc sự cố tương quan đến axit HNO3
- Hít buộc phải hơi axit: nhanh chóng di chuyển nạn nhân mang lại nơi loáng khí và nên cứu trị y tế ngay lập tức lập tức.
- Axit bắn vào mắt: mau chóng rửa mắt các lần bởi nước sạch.
- Axit phun vào da: Cởi bỏ ngay phần áo quần bị bám axit và rửa vùng domain authority bị bắn axit bằng nước không bẩn trong khoảng thời hạn ít nhất là 15 phút.
- Nuốt phải: Ngay mau lẹ súc miệng thật sạch sẽ với hỗn hợp nước hoặc sữa, tuyệt vời và hoàn hảo nhất không cho ngẫu nhiên vật gì vào miệng của nạn nhân nếu không có sự gật đầu đồng ý của chưng sĩ.
Những chú ý khi thực hiện và bảo vệ axit nitric
Khi áp dụng HNO3
- Mặc đồ bảo hộ bình an khi làm việc với axit nitric, bao hàm có áo quần dài tay, kính mắt, bao tay tay, khẩu trang, mũ, giày,….

Mặc đồ dùng bảo hộ bình yên khi làm việc với axit nitric
- vị trí làm việc bảo đảm an toàn thông thoáng, sạch sẽ sẽ, kị xa các vật dụng dễ cháy nổ.
- khi pha loãng axit, tuyệt vời không đổ nước vào bên trong dung dịch axit nitric mà nên cho axit vào nước.
Khi bảo vệ HNO3
- bảo vệ axit nitric trong khu vực vực bình yên và né xa những vật liệu ko tương thích, lấy ví dụ như như những hợp chất hữu cơ, rượu, hơi ẩm hoặc kim loại.
- mặt nền nhà kho phải được gia công bằng đồ liệu cản trở được axit.
- khu vực bảo quản phải bảo đảm an toàn thông thoáng, né xa những nguồn phát nhiệt độ và tia nắng mặt trời.
- Thùng chứa axit đề nghị được đậy kín đáo nắp và vật liệu làm thùng buộc phải là làm từ chất liệu nhựa cụ vì sắt kẽm kim loại vì HNO3 không tính năng với gia công bằng chất liệu này.
Nguyên tắc giải bài tập về axit nitric
Nguyên tắc giải bài tập về axit nitric là sử dụng định phương tiện bảo toàn e
N(+5) → + ne
+ (5 – x)e →
Þ ne nhường nhịn = ne nhấn Chú ý:
Nếu phản bội ứng tạo nên nhiều thành phầm khử của N thì số mol e nhường nhịn = tổng thể mol e nhậnNếu có tương đối nhiều chất khử gia nhập phản ứng toàn bô mol e nhường = số mol e nhận
Trong một trong những trường phù hợp cần phối hợp thêm định dụng cụ bảo toàn điện tích, có nghĩa là tổng năng lượng điện âm = tổng điện tích dương cùng định dụng cụ bảo toàn nguyên tố
Chúng ta rất có thể sử dụng phương trình ion – electron hoặc những bán bội phản ứng để biểu diễn các quá trình hóa học đã xảy ra, rõ ràng như sau:
M → Mn+ + ne
4H+ + NO3- + 3e → NO + 2H2O
Với trường kim loại tổng hợp loại chức năng với axit nitric, ta sẽ có:
n
HNO3 làm phản ứng = 2n
NO2 = 12n
N2 = 10n
NH4NO3 = 4n
NO = 10n
N2O
n
NO3-trong muối bột = n
NO2 = 10n
N2 = 8n
NH4NO3 = 3n
NO = 8n
N2O
Nếu lếu hợp bao hàm cả kim loại và oxit kim loại phản ứng với axit nitric, đưa sử xuất hiện khí NO thì:
n
HNO3 phản ứng = 4n
NO + 2n
O (trong oxit kim loại)
Các dạng toán liên quan axit nitric
Phương pháp xác định nhanh thành phầm khử của axit nitric
Sản phẩm khử của axit nitric bao gồm:
Kí hiệu sản phẩm khử | Dấu hiệu nhận biết | Công thức bảo toàn electron |
NO2 ↑ | Khí gồm màu nâu đỏ | N+5 + 1e → N+4 (NO2) |
NO ↑ | Khí không màu cùng hóa nâu lúc đặt ngoài không khí | N+5 + 3e → N+2 (NO) |
N2O ↑ | Khí ko màu và dễ gây cháy | 2N+5 + 8e → N2+1 (N2O |
N2 ↑ | Khí ko màu và không khiến cháy | 2N+5 + 10e → N2+0 (N2) |
NH4NO3 (oxi hóa lên các hóa trị -3; +1; +5; -2) NO3-1 | Dung dịch và muối | N+5 + 8e → N-3 (NH4NO3) |
Dạng 1
Khi vẫn biết số mol của thành phầm khử (X)
Để xác định được thành phầm khử, ta đề xuất tính k số e trung bình tạo thành 1 mol X, ký hiệu là k
K = (∑ne (cho/ nhận) của N+5 tạo ra sản phẩm khử X) ÷ n
X
Ví dụ như NO2 = 1÷1=1; NO = 3÷1=3...
Dạng 2
Khi chưa cho biết thêm số mol của Nx
Kim loại tính năng với axit nitric tạo thành muối(NO3)- + X + sản phẩm khử không giống + H2O
Các bước giải bài xích tập là:
Bước 1: Áp dụng cách thức bảo toàn số mol N: n
N(X) = n
HNO3 phản ứng - n
N(muối) - n
N(sản phẩm khử khác)
Bước 2: Tính
t = (∑ne(cho/ nhận) của N+5 tạo X) ÷ n
N(X)
Ví dụ t = 1 → NO2; t = 3 → NO...
Dạng 3
Nếu đề bài xích không cho tương đối đầy đủ các dữ liệu thì áp dụng phương thức chặn khoảng k.
Dạng 4
Kim loại tác dụng với axit nitric tạo nên muối NH4NO3. Những kim loại thường đã là Mg, Al, Zn
- dấu hiệu định tính
Dung dịch sau bội nghịch ứng tính năng với OH- tạo ra khí nặng mùi khai là amoniacKim loại tác dụng với axit nitric thì không có khí bay ra
Số muối chế tạo ra ra to hơn số sắt kẽm kim loại phản ứng
- tín hiệu định lượng
Khối lượng hỗn hợp tăng bởi với trọng lượng kim các loại phản ứng∑n(e) cho sắt kẽm kim loại phản ứng to hơn ∑n(e) của N+5 tạo khíSản phẩm khí độc nhất vô nhị (không bao gồm NH4NO3) khác với thành phầm khí tuyệt nhất (có NH4NO3)
Axit nitric mua nơi đâu chất lượng, giá rẻ tại Hà Nội
Sau khi đã tìm hiểu xong xuôi thông tin về axit nitric là gì, có lẽ rằng nhiều ai đang rất thân yêu đến địa chỉ mua axit nitric chất lượng và giá chỉ rẻ. Ngay lập tức bây giờ, cửa hàng chúng tôi sẽ đưa ra cho các bạn một nhắc nhở vì địa chỉ mua axit nitric giá chỉ rẻ, đó chính là công ty giaoducq1.edu.vn.
Đến cùng với giaoducq1.edu.vn, các bạn sẽ nhận được những thành phầm vừa có quality đảm bảo, vừa có ngân sách chi tiêu phải chăng với còn được hỗ trợ giao hàng trên toàn quốc với khoảng phí khôn xiết ưu đãi. Không tính ra, chúng tôi cũng cung ứng thêm không ít sản phẩm hóa chất công nghiệp, chất hóa học tẩy rửa, xi mạ,…của các thương hiệu khét tiếng trên thế giới với số lượng lớn để ship hàng kịp thời nhu cầu sử dụng của khách hàng hàng.
Tính hóa chất và quy trình sản xuất Axit Nitric HNO3 ?Axit Nitric là trong số những hợp chất hóa học bao gồm tính axit cùng oxy hóa mạnh bạo được sử dụng rất rộng rãi trong đời sống hiện nay, nhất là với nghành nghề sản xuất công nghiệp. Vậy hóa chất này còn có những tính chất đặc trưng gì, người ta pha chế chúng bằng phương pháp nào cùng nó được ứng dụng cụ ra sao trong các lĩnh vực? Hãy thuộc giaoducq1.edu.vn đi kiếm hiểu về axit nitric qua nội dung bài viết dưới trên đây nhé
Axit Nitric – HNO3 là gì?
Axit nitric tất cả công thức chất hóa học là HNO3, được điện thoại tư vấn là hỗn hợp nitrat hidro hay nói một cách khác là axit nitric khan. Axit này được ra đời ở trong tự nhiên, tạo thành từ những cơn mưa do sấm và sét tạo nên thành.
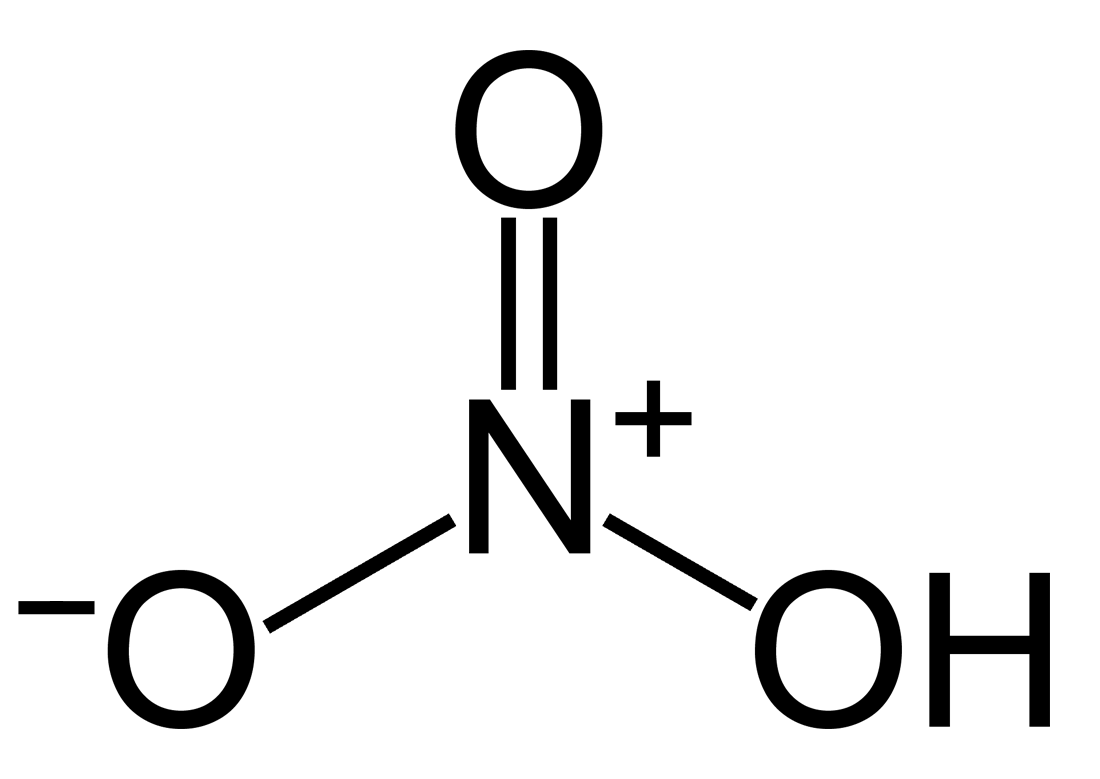
Cấu tạo phân tử Axit Nitric – HNO3

Cấu tạo ra phân tử - HNO3
Tính hóa học vật lý của axit nitric
Axit nitric tồn tại sinh sống dạng chất lỏng hoặc khí, không màu, tan nhanh trong nước (C, 65%). Hợp chất này trong tự nhiên sẽ sở hữu màu tiến thưởng nhạt do sự hội tụ của oxit nito.HNO3 là 1 trong những axit tất cả tính bào mòn cao, dễ bắt lửa và rất độc.Axit nitric độ đậm đặc 86% khi đặt ngoài không khí sẽ có hiện tượng sương trắng bốc lên.Tỷ trọng của axit nitric tinh khiết: 1511 kg/m3Nhiệt độ đông đặc: -41 độ CNhiệt độ sôi: 83 độ CDưới chức năng của ánh sáng, axit nitric bị phân hủy tạo ra thành nito dioxit NO2 ( nhiệt độ thường).4HNO3 → 4NO2 + 2H2O + O2
Cần bảo vệ HNO3 trong các chai lọ về tối màu, tránh vị trí có ánh nắng và bảo vệ ở ánh nắng mặt trời dưới 0 độ C.
Axit nitric có thể hòa tan nito dioxit thành dung dịch bao gồm màu kim cương hoặc đỏ ở ánh nắng mặt trời cao. Điều này tác động không nhỏ dại đến những đặc trưng vật lý của chất này, đặc biệt là áp suất hơi trên hóa học lỏng, color dung dịch, ánh sáng sôi,... Phụ thuộc vào độ đậm đặc NO2.Khi bác bỏ cất các thành phần hỗn hợp HNO3 cùng H2O ta thu nhận được azeotrope có nồng độ 68% HNO3 cùng sôi sinh hoạt 120,5 độ C, 1atm.
Axit nitric tồn tại ở dạng chất lỏng hoặc khí, ko màu, tan nhanh trong nước
Tính hóa chất của HNO3
Axit nitric là 1 dung dịch nitrat hydro tất cả công thức hóa học HNO3 . Đây là một axit khan, là một monoaxit mạnh, tất cả tính oxy hóa mạnh có thể nitrat hóa nhiều hợp chất vô cơ, gồm hằng số thăng bằng axit (p
Ka) = −2.
Axit nitric là một monoproton chỉ tất cả một sự phân ly bắt buộc trong dung dịch, nó bị điện ly hoàn toàn thành các ion nitrat NO3− cùng một proton hydrat, hay còn gọi là ion hiđroni.
H3O+ HNO3 + H2O → H3O+ + NO3-
Axit nitric có đặc thù của một axit thông thường nên nó làm cho quỳ tím gửi sang màu đỏ.Tác dụng với bazo, oxit bazo, muối hạt cacbonat sinh sản thành những muối nitrat 2HNO3 + Cu
O → Cu(NO3)2 + H2O
2HNO3 + Mg(OH)2 → Mg(NO3)2 + 2H2O
2HNO3 + Ca
CO3 → Ca(NO3)2 + H2O + CO2
kim loại + HNO3 sệt → muối nitrat + NO + H2O ( to)
kim loại + HNO3 loãng → muối bột nitrat + NO + H2O
sắt kẽm kim loại + HNO3 loãng giá buốt → muối hạt nitrat + H2
Mg(rắn) + 2HNO3 loãng rét → Mg(NO3)2 + H2 (khí)

C + 4HNO3 quánh → 4NO2 + 2H2O + CO2
phường + 5HNO3 đặc → 5NO2 + H2O + H3PO4
3C + 4HNO3 loãng → 3CO2 + 4NO + 2H2O
Tác dụng cùng với oxit bazo, bazo, muối bột mà sắt kẽm kim loại trong hợp hóa học này không lên hóa trị cao nhất: Fe
O + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
Fe
CO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
3H2S + 2HNO3 (>5%) → 3Skết tủa + 2NO + 4H2O
Pb
S + 8HNO3 sệt → Pb
SO4 kết tủa + 8NO2 + 4H2O
Ag3PO4 tan vào HNO3, Hg
S không tính năng với HNO3.
Điều chế axit nitric - HNO3
Trong trường đoản cú nhiên, axit nitric được tạo nên từ những cơn mưa lớn có sét, tạo ra những trận mưa axit.
1. Điều chế axit nitric - HNO3 trong phòng thí nghiệm
Người ta mang lại muối natri nitrat tinh thể tính năng với axit sunfuric đặc, bác bỏ cất các thành phần hỗn hợp này tại ánh sáng sôi của axit nitric là 83 °C cho đến khi còn sót lại chất kết tinh màu sắc trắng. Tuy nhiên, phương pháp này chỉ tạo ra một lượng nhỏ tuổi axit.
H2SO4 quánh + Na
NO3 (tinh thể) → HNO3 + Na
HSO4
Axit nitric bốc sương đỏ thu được hoàn toàn có thể chuyển thành axit nitric màu sắc trắng. Khi triển khai thí nghiệm , những dụng cụ đề xuất làm từ bỏ thủy tinh, đặc biệt là bình cổ cong nguyên khối vày axit nitric khan.
2. Điều chế axit nitric - HNO3 trong công nghiệp
Axit nitric loãng hoàn toàn có thể cô đặc mang đến 68% axit với một tất cả hổn hợp azeotropic cùng với 32% nước. Để chiếm được axit gồm nồng độ cao hơn, thực hiện chưng chứa với axit sunfuric H2SO4. H2SO4 đóng vai trò là hóa học khử vẫn hấp thụ lại nước.
4NH3 + 5O2 → 4NO + 6H2O (Pt, 850o
C)
2NO + O2 → NO2
4NO2 + O2 + 2H2O → 4HNO3
Dung dịch axit nitric công nghiệp thông thường có nồng độ 52% và 68%. Bài toán sản xuất axit nitric được thực hiện bằng công nghệ Ostwald vị Wilhelm Ostwald phát minh.
Ứng dụng của axit nitric - HNO3 trong trong thực tiễn là gì?

Một số ứng dụng của axit nitric - HNO3
1. Trong chống thí nghiệm
Hợp hóa học axit nitric đa phần được thực hiện làm thuốc thử liên quan tới clorit. Fan ta đến HNO3 tính năng với mẫu mã thử, tiếp nối cho dung dịch bội nghĩa nitrat vào tất cả hổn hợp để kiếm tìm kết tủa trắng của bạc đãi clorua. Ngoài ra, axit nitric còn được áp dụng để pha trộn muối nitrat.2. Trong công nghiệp
Axit nitric 68% được thực hiện để chế tạo thuốc nổ bao gồm trinitrotoluen (TNT), nitroglycerin, cyclotrimethylenetrinitramin (RDX), và những loại phân bón cất ni-tơ như phân đạm một lá nitrat amoni NH4NO3, các muối nitrat như Ca(CO3)2, KNO3,...HNO3 mật độ 0,5 - 2 % được sử dụng làm hợp hóa học nền nhằm khẳng định có sắt kẽm kim loại tồn tại trong dung dịch hay không. Bạn ta hotline đó là chuyên môn ICP-AES với ICP-MS. Để tác dụng phân tích được chuẩn chỉnh xác cần sử dụng HNO3 tinh khiết hay đối. HNO3 bội nghịch ứng với hầu hết với những hợp hóa học hữu cơ cho nên nó được thực hiện nhiều trong ngành luyện kim, tinh lọc cùng xi mạ. Khi đến axit nitric tác dụng với axit clorua, ta được dung dịch cường toan có chức năng hòa tan cùng và bạch kim.Axit nitric còn được thực hiện trong sản xuất những chất hữu cơ, sơn, bột màu, thuốc nhuộm vải.HNO3 còn được sử dụng làm dung dịch tẩy màu sắc để khác nhau morphine với heroin.Hợp hóa học HNO3 được áp dụng để cung cấp nitrobenzen - tiền hóa học để cung cấp anilin và những dẫn xuất của chính nó - ứng dụng then chốt trong sản xuất sợi aramit, bọt bong bóng xốp polyuretan cùng dược phẩm.Axit nitric còn là hợp hóa học trung gian vào sản xuất các chất kết dính, hóa học bộc phủ, chất trùm kín và những chất bầy hồi đi từ bỏ toluen diisoxyanat.Trong các nhà sản phẩm công nghệ sữa, tín đồ ta sử dụng HNO3 làm chất tẩy rửa những đường ống, bề mặt kim loại. Axit nitric còn được sử dụng để đào thải các tạo chất và thăng bằng lại độ tiêu chuẩn chỉnh của nước. Một một trong những ứng dụng khác mang lại IWFNA là 1 chất lão hóa trong nguyên liệu lỏng tên lửa.Mức độ nguy khốn của axit nitric, cần để ý biện pháp phòng kị nào?
1. Phần đông tổn thương khi tiếp xúc HNO3
Hít phải: có tác dụng tổn yêu thương hệ hô hấp, có thể khiến phổi bị sưng.Nuốt phải: khiến cho vùng miệng, họng, thực quản, dạ dày bị bỏng, gây nguy khốn tới tính mạng. Nhẹ sẽ gây nôn ói, tiêu chảy. Nặng rất có thể khiến tuần trả máu bị rối loạn, tạo tử vong.Dây vào mắt: làm cho tổn yêu mến giác mạc, rất có thể dẫn tới mù lòa.Tiếp xúc với da: Gây bỏng da.Phơi nhiễm lâu có thể dẫn cho tới ung thư.Khi thao tác với axit nitric đề xuất mang dụng cụ bảo lãnh lao đụng an toàn.
Tác sợ hãi của HNO3
2. Giải pháp xử lý sự cố vì chưng axit nitric khiến ra
Axit phun vào mắt: ngay lập tức sử dụng nước sạch nhằm rửa mắt, phối hợp nháy đôi mắt trong 15 phút. Tiếp đến dùng muối bột natri clorua 0.9% nhằm rửa lại rồi mang lại cơ sở y tế nhằm được chữa bệnh tiếp.
Axit xúc tiếp với da: Lột bỏ quần áo bị bám axit, thực hiện khăn khô lau lốt thương rồi thực hiện nước sạch sẽ (dùng xà phòng nếu có) để rửa lại nhiều lần. Đưa nạn nhân tới bệnh viện để khám chữa tiếp.
Hít cần hơi axit nitric: dịch rời nạn nhân ra quanh vùng thoáng khí, ủ ấm. Để nạn nhân nằm im rồi liên lạc với khám đa khoa gần nhất.
Nuốt yêu cầu axit nitric: hòa hợp Mg
O cùng với nước hoặc sữa với lòng trắng trứng rồi đưa tới cơ sở y tế bên gần đó để điều trị.
Hỏa hoạn xẩy ra do axit nitric: áp dụng bột khô, bình khí cacbon dioxit để dập lửa. áp dụng dung dịch kiềm để th-nc axit. Dịch chuyển các thùng chứa, hoặc dùng nước để làm nguội những thùng này tránh sự cố phát nổ.
Trường phù hợp axit nitric bị tràn, rò rỉ: thực hiện cát, đất để trùm lên chỗ axit tràn ra. Sau đó dùng Ca(OH)2 hoặc soda khan để trung hòa. Sử dụng nước làm sạch khoanh vùng hóa hóa học bị rò rỉ.
Những để ý khi sử dụng axit nitric - HNO3
Axit nitric là hóa học oxy hóa mạnh, khi chức năng với cyanit, bột kim rất có thể phát nổ cùng tự bốc cháy khi phản ứng cùng với turpentine.Ở nồng độ đậm đặc, nó gây bỏng da bởi vì phản ứng với protein keratin, khiến cho da đưa sang màu sắc vàng. Lúc được trung hòa sẽ đưa thành color cam.Có thể phản bội ứng mạnh với sắt kẽm kim loại tạo thành khí hydro dễ dàng cháy trong ko khí.Khi pha loãng, hoàn hảo nhất không được đổ nước vào axit mà đề nghị cho axit vào nước.Sử dụng các thùng chứa bởi nhựa cầm cho kim loại vì axit nitric không chức năng với làm từ chất liệu này.Các thùng chứa nên đậy nắp kín, tránh ánh nắng mặt trời.Khu vực lưu trữ phải loáng mát, né xa các nguồn nhiệt.Nền nhà phải cản trở được axit.Mua axit nitric chỗ nào tại Hà Nội, thành phố Hồ Chí Minh
giaoducq1.edu.vn là doanh nghiệp nhập khẩu cùng phân phối những loại hóa chất công nghiệp, phương tiện thí nghiệm, thiết bị công nghệ kỹ thuật số 1 Việt Nam, nhận được sự ủng hộ, tin yêu của doanh nghiệp trong cả nước.
Với hệ thống hơn 50 xe tải cùng đội ngũ nhân viên giao hàng nhanh nhẹn, niềm nở và ý thức trách nhiệm cùng với công việc, bọn chúng tôi cam đoan sẽ cung ứng kịp thời cho người sử dụng những sản phẩm chất lượng cao trong thời gian sớm nhất với mức giá thành cạnh tranh.
Xem thêm: Bài giảng ôn dịch thuốc lá thư viện bài giảng điện tử archives
Các sản phẩm hóa hóa học của giaoducq1.edu.vn hầu hết được kiểm định chất lượng nghiêm ngặt từ bỏ nguồn vật liệu đầu vào tới thành quả cuối cùng. Mọi quá trình sản xuất từ pha chế tới đóng góp gói, giao hàng đều được giám sát ngặt nghèo bởi những kỹ sư có chuyên môn cao, tiêu chuẩn làm chủ chất lượng ISO 9001:2015 và quản lý môi ngôi trường theo tiêu chuẩn hệ thống ISO 14001: 2015.