Hiệu suất là gì, ai đang muốn tìm hiểu về định nghĩa, công thức tính hiệu suất phản ứng hóa học, vật lý, cơ học, hiệu suất chuyển đổi năng lượng, hiệu suất nhiệt chính xác nhất. Lúc này ở nội dung bài viết này trung học phổ thông CHUYÊN LAM SƠN shop chúng tôi xin chia sẻ đến chúng ta công thức tính công suất phản ứng hóa học của một chất tương đối đầy đủ chi tiết.
Bạn đang xem: Công thức tính hiệu suất trong hóa học
Hiệu suất là gì ?
Hiệu suất được định nghĩa là kĩ năng giúp tránh lãng phí cho toàn bộ mọi fan trong công việc và sinh hoạt mặt hàng ngày. Trong những việc mất tương đối nhiều công sức, chi phí bạc, thời gian… Đặc biệt, nếu như hiệu suất càng cao thì quá trình của các bạn sẽ tốt hơn từng ấy và ngược lại.
Công thức tính hiệu suất phản ứng hóa học
=> Hiệu suất tỷ lệ của phản bội ứng hóa học được xem theo cách làm như sau: % hiệu suất = ( cân nặng tt/ khối lượng lt) x 100 %.
Công thức tính hiệu suất như sau : H = m(tt)/m(lt) x 100%Trong đó
H là công suất phản ứng (%)m(tt) là khối lượng thực tế tính bằng (g)m(lt) là trọng lượng lý thuyết ( tính theo phương trình ) (g)
=> Còn độ hao giá thành của phản nghịch ứng thì cần phải dựa theo tỷ lệ được tính theo công thức: % hao giá thành = 100% – % hiệu suất.
Ví dụ minh họa
Ví dụ 1: bạn ta nung 4,9 gam KCl
O3 bao gồm xúc tác chiếm được 2,5 gam KCl với một lượng khí oxi.
a. Viết phương trình hóa học xảy ra.
b. Tính công suất của làm phản ứng
Hướng dẫn giải:
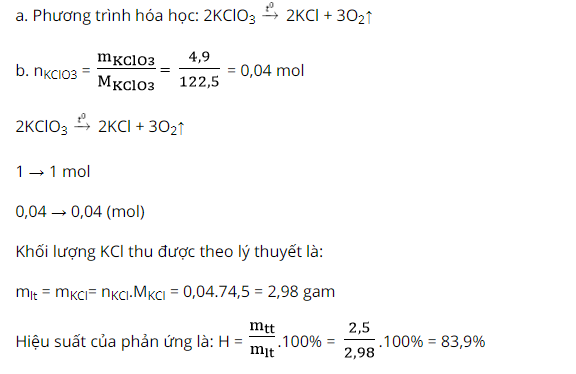
Ví dụ 2: Nung 100 kg Ca
CO3 thì thu được 47,6kg Ca
O. Tính năng suất của phản bội ứng.
Biết phản nghịch ứng xẩy ra như sau: Ca
CO3 bí quyết giải bài xích tập tính hiệu suất phản ứng cực hay, chi tiết | chất hóa học lớp 8 Ca
O + CO2
Hướng dẫn giải:
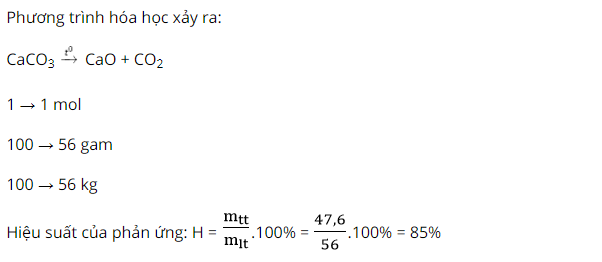
Ví dụ 3: Nung lạnh kali nitrat KNO3, hóa học này bị phân hủy sinh sản thành kali nitrit KNO2 với O2. Tính khối lượng KNO3 cần dùng làm điều chế được 2,4 gam O2. Biết năng suất phản ứng đạt 85%.
Hướng dẫn giải:
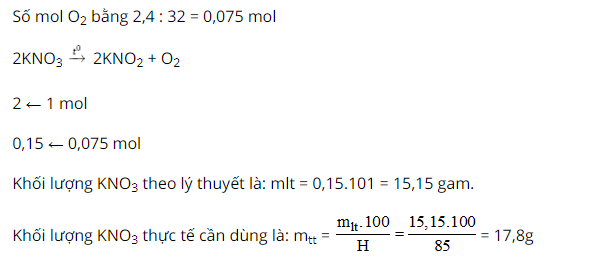
Công thức tính hiệu suất của nguồn điện


Với những phân tách sẻ về các dạng công thức tính hiệu suất bên trên mong sẽ giúp được các bạn hiểu rộng phần nào lúc cần áp dụng vào bài tập.
Bạn đã tìm kiếm cách làm tính hiệu suất của phản ứng hoá học, nhằm giải bài tập một cách nhanh chóng nhất. Xem thêm ngay nội dung bài viết dưới trên đây để thâu tóm công thức dễ dàng và cực kỳ dễ nhớ.
1. Công suất của phản nghịch ứng hoá học tập là gì
Trong môn hoá học, lượng thuyết là số lượng sản phẩm tối đa mà lại một phản ứng hoá học hoàn toàn có thể tạo ra vào phương trình hoá học, Theo đó, hầu hết các làm phản ứng hầu hết không xảy ra trọn vẹn (hầu hết là như vậy).

Theo đó, công thức tính hiệu suất phản ứng được tính như sau: %hiệu suất = (lượng thực tế/ lượng lý thuyết) x 100. Năng suất phản ứng 90%, là phản bội ứng mang đến năng suất 90%, 10% là tích điện bị bỏ lỡ và không phản ứng, quan yếu thu lại hết.
Hiệu suất hoàn toàn có thể đo được nhằm tránh tiêu tốn lãng phí năng lượng, tài lộc và thời gian để sản xuất ra kết quả như ý muốn đợi. Tính hiệu suất cũng giống như việc làm sao đo được nguồn tích điện tối đa.
2. Công thức tính năng suất của phản ứng hoá học
Ví dụ:
A+B-> C thì hiệu suất phản ứng được xem theo công thức
H = số mol phản bội ứng * 100%/ số mol ban đầu
Tính theo khối lượng:
H = khối lượng thu được trong thực tiễn .100%/khối lượng thu được tính theo phương trình (hiệu suất số mol hóa học thiếu được tính theo số mol nhỏ. Tự đó hoàn toàn có thể tính được n
C = n
A bội phản ứng = (n
Aban đầu .H)/100
n
A lúc đầu cần dùng: n
A ban đầu) = (n
C.100)/H

3. Bí quyết tính trọng lượng chất thâm nhập khi tất cả hiệu suất
Hiệu suất phản bội ứng nhỏ tuổi hơn 100%, lượng hóa học tham gia thực tế đem vào làm phản ứng cần hơn nhiều để bù vào sự hao hụt. Sau thời điểm tính được trọng lượng chất thâm nhập phản ứng theo phương trình, ta có cân nặng chất thâm nhập khi tất cả hiệu suất:
Công thức tính trọng lượng sản phẩm khi gồm hiệu suất
Có Thể Bạn thân thương : bí quyết tính điện năng tiêu hao cơ bản và hiệu quả
Hiệu suất làm phản ứng nhỏ tuổi hơn 100%, vị đó sản phẩm thu được sẽ nhỏ hơn sự hao hụt. Sau khi cân nặng sản phẩm tính theo phương trình phản bội ứng, ta và tính được trọng lượng sản phẩm khi bao gồm hiệu suất:
Ví dụ minh hoạ:
Nung rét 0,1 mol Ca
CO3 thì ta thu được 0,08 mol Ca
O. Vậy, hãy tính hiệu suất phản ứng hóa học xảy ra.
Trong bài xích này chúng ta có 2 phương pháp để giải bài bác toán:
Cách 1:
Ca
CO3 ——–> Ca
O + CO2
0,1 mol —-> 0,1 mol
Theo bội nghịch ứng bên trên ta bao gồm 0,1 mol Ca
CO3 sinh sản 0,1 mol Ca
O. Tuy nhiên theo công dụng thực tế thì chỉ đo được 0,08 mol Ca
O. Như vậy đối với Ca
O lượng đo lường và tính toán theo phản nghịch ứng là 0,1 (gọi là cân nặng theo lý thuyết) cùng lượng chắc hẳn rằng thu được là 0,08 (gọi là lượng thực tế). Công suất phản ứng H(%) = (thực tế/lý thuyết)*100 = (0,08/0,1)*100 = 80%, tức là:
Cách 2:
Có Thể Bạn ân cần : lưu ý công thức tính diện tích hình bình hành
Ca
CO3 ——–> Ca
O + CO2
0,08 mol
Nhìn tỉ trọng mol trên phương trình trường hợp thu được 0,08 mol vôi sống Ca
O đề xuất dùng 0,08 mol Ca
CO3. Tuy nhiên, theo đề bài xích đã cho là nung 0,1 mol Ca
CO3.
Tóm lại đối với Ca
CO3 lượng thống kê giám sát theo phản bội ứng là 0,08 (gọi là lựong lý thuyết) và lượng chắc chắn cần phải có là 0,1 (gọi là lượng thực tế). Hiệu suất phản ứng H= lý thuyết/thực tế)*100 = (0,08/0,1)*100 = 80%
Kết luận: tóm lại khi tính năng suất phản ứng thì chúng ta cần xác minh xem mình nhờ vào tác hóa học hay sản phẩm để sở hữu công thức cân xứng để tính.
+ Nếu phụ thuộc sản phẩm thì công thức: H = (thực tế/lý thuyết)*100
+ Nếu phụ thuộc vào tác hóa học thì công thức: H = (lý thuyết/thực tế)*100
Các bàn sinh hoạt sinh rất có thể rút tởm nghiệm, lúc làm bài đừng xem xét thực tế, lý thuyết. đề nghị thực hiện đo lường và tính toán bình thường, nhờ vào tác hóa học hay thành phầm tùy ý, kế tiếp đối chiếu lượng sống đề bài bác cho xem cực hiếm nào lớn, quý hiếm nào nhỏ.
Hiệu suất = (giá trị nhỏ/giá trị lớn)*100
4. Bài tập gợi nhắc về tính hiệu suất
Bài tập 1: Tính khối lượng Na và thể tích khí Cl2 cần dùng làm điều chế 4,68 gam muối bột Clorua, nếu hiệu suất phản ứng là 80%

Lời Giải:
n Na
Cl = m Na
Cl/ M Na
Cl = 4,68/58,5 = 0,08 (mol)
Phương trình hóa học:
2Na + Cl2 → 2Na
Cl
từ pt => số mol na = 0,08*100/80 = 0,1 (mol)
n Cl2 = (0,08*100)/2*80 = 0,05 (mol)
m mãng cầu = 0,1*23 = 2,3 (gam)
V Clo = 0,05*22,4 = 1,12 (lit)
Bài tập 2: mang lại 19,5 gam Zn làm phản ứng cùng với 7 (l) clo thì thu được 36,72 gam Zn
Cl2. Tính năng suất của làm phản ứng?
Bài Giải
Có Thể Bạn thân thiện : 5 bí quyết tính thể tích quan trọng đừng vứt lỡ
n Zn = 19,5/65 = 0,3 (mol)
n Cl2 = 7/22,4 = 0,3125 (mol)
n Zn
Cl2 = 0,27 (mol)
Zn + Cl2 → Zn
Cl2
Ta thấy:
n Cl2 > n Zn => so với Cl2 thì Zn là hóa học thiếu, vì thế ta sẽ tính theo Zn.
Xem thêm: Soạn Bài Phong Cách Ngôn Ngữ Văn 12 Phong Cách Ngôn Ngữ Khoa Học (Trang 71)
Từ phương trình => n Zn làm phản ứng = n Zn
Cl2 = 0,27 (mol)
Hiệu suất phản ứng: H = số mol Zn phản ứng *100/số mol Zn ban đầu
= 0,27 * 100/0,3 = 90 %
Trên đó là nội dung cụ thể về công thức tính năng suất của bội nghịch ứng hoá học, với đó là rất nhiều ví dụ minh hoạ và giải pháp giải bài tập chi tiết, góp học sinh thuận lợi luyện tập, ghi nhớ nhanh chóng. Hãy nỗ lực ôn tập với giải thêm nhiều bài bác tập tương tự như để áp dụng các công thức nhuần nhuyễn hơn.