- Với oxi: Ở to thường chế tạo ra lớp màng oxit bảo vệ. Trường hợp đốt bột nhôm thì vẫn phản ứng mạnh.
Bạn đang xem: Nhôm và hợp chất của nhôm
4Al + 3O2 (xrightarrowt^o) 2Al2O3
- cùng với phi kim khác:
+ với Cl2, Br2 phản ứng ngay nghỉ ngơi to thường tạo thành thành Al
Cl3, Al
Br3 phản ứng bốc cháy.
Ví dụ:
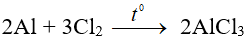
+ khi đun nóng, bội nghịch ứng được với I2, S. Khi đun cho nóng mạnh, làm phản ứng được cùng với N2, C.
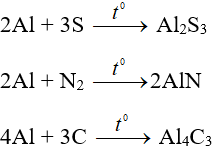
2. Tác dụng với axit
- Al + dung dịch axit (HCl, H2SO4) → muối bột + H2
2Al + 6H+ → 2Al3+ + 3H2
- Al + hỗn hợp axit (có tính OXH mạnh) → muối bột + thành phầm khử + H2O
4Al + 4HNO3 loãng (xrightarrowt^o) Al(NO3)3 + NO + 2H2O
2Al + 6H2SO4 đặc (xrightarrowt^o) Al2(SO4)3 + 3SO2 + 6H2O
- Al không tính năng với H2SO4, HNO3 quánh nguội.
3. Tính năng với oxit kim loại
Ở nhiệt độ cao, Al khử được nhiều oxit sắt kẽm kim loại như Fe2O3, Cr2O3,... Thành sắt kẽm kim loại tự do.
2Al + Fe2O3 (xrightarrowt^o) Al2O3 + 2Fe
4. Chức năng với hỗn hợp kiềm
2Al + 2Na
OH + 6H2O → 2Na(left< Al(OH)_4
ight>)(dd) + 3H2
IV. ỨNG DỤNG VÀ SẢN XUẤT
1. Ứng dụng
- tín đồ ta sử dụng nhôm để chế tạo vỏ thứ bay, tên lửa, tàu vũ trụ bởi vì đặc tính nhẹ, bền với ko khí với nước
- làm dây dẫn năng lượng điện cao áp, đồ vật nội thất, có tác dụng vật bàn bạc nhiệt
- chế tạo hỗn phù hợp tecmit (Al và Fe2O3) được dùng làm hàn gắn mặt đường ray.
2. Sản xuất
Điện phân lạnh chảy Al2O3
2Al2O3 (xrightarrow extđpnc) 4Al + 3O2
B. MỘT SỐ HỢP CHẤT quan liêu TRỌNG CỦA NHÔM
I. NHÔM OXIT
Tính chất vật lí : là hóa học rắn màu trắng, ko tan trong nước lạnh chảy sống 2050 độ C
Tính chất hóa học : Al2O3 là oxit lưỡng tính, tác dụng được cùng với dung dịch axit và dung dịch kiềm:
Al2O3 + 6HCl → 2Al
Cl3 + 3H2O
Al2O3 + 2Na
OH + 3H2O → 2Na(left( Al(OH)_4
ight))
Ứng dụng :
- Tinh thể Al2O3 (corinđon) được sử dụng làm thứ trang sức, sản xuất các cụ thể trong các ngành kĩ thuật bao gồm xác, như chân kính đồng hồ, thiết bị phát tia lade,...
- Bột Al2O3 có độ cứng cao được sử dụng làm vật tư mài.
- Boxit Al2O3.2H2O là vật liệu sản xuất nhôm kim loại.
II. NHÔM HIDROXIT
Tính chất vật lí: Là chất kết tủa keo, color trắng, không tan vào nước, dễ dẫn đến nhiệt phân hủy
Tính hóa học hóa học :
- dễ bị nhiệt phân thành nhôm oxit :
2Al(OH)3 (xrightarrowt^o) Al2O3 + 3H2O
- Là hợp hóa học lưỡng tính, chảy trong axit và bazo
Al(OH)3 + 3HCl → Al
Cl3 + 3H2O
Al(OH)3 + Na
OH → Na(left< Al(OH)_4
ight>)
Điều chế: cho muối nhôm bội nghịch ứng với hỗn hợp NH3 hoặc muối hạt Na2CO3 :
2Al
Cl3 + 3Na2CO3 + 3H2O → 2Al(OH)3↓ + 6Na
Cl + 3CO2↑
III. NHÔM SUNFAT
- Al2(SO4)3: là chất bột màu sắc trắng, bị phân hủy nhiệt bên trên 770o
C
- Phèn chua: K2SO4.Al2(SO4)3.24H2O hoặc : KAl(SO4)2.12H2O tồn tại sinh sống dạng tinh thể gồm vị hơi chua cùng chát.
Dựa theo cấu trúc SGK chất hóa học 12, giaoducq1.edu.vn xin share với chúng ta bài: Nhôm và hợp hóa học của nhôm. Với kỹ năng và kiến thức trọng trung tâm và các bài tập có giải mã chi tiết, mong muốn rằng đây đang là tư liệu giúp các bạn học tập giỏi hơn.

A – KIẾN THỨC TRỌNG TÂM
NHÔM
I. Vị trí trong bảng tuần hoàn, thông số kỹ thuật electron nguyên tử.
Nhôm thuộc sinh sống ô số 13, thuộc đội IIIA, chu kì 3 của bảng tuần hoàn.
Cấu hình electron :
II. Tính chất vật lí
Nhôm là kim loại white color bạc, dễ kéo sợi, dát mỏng
Nhôm là kim loại nhẹ, dẫn năng lượng điện tốt, dẫn nhiệt độ tốt.
III. đặc điểm hóa học.
Nhôm tất cả tính khử mạnh, chỉ sau KL kiềm và kiềm thổ.
Al → Al3+ + 3e
1. Tính năng với phi kim: khử nguyên tử phi kim thành ion âm.
Tác dụng cùng với oxi: 4Al + 3O2 →(to) 2Al2O3Tác dụng với halogen: 2Al + 3Cl2→2AlCl3
2. Tính năng với axit
Nhôm khử H+ trong axit HCl và H2SO4 loãng thành khí H22Al +6H+→ 2Al3+ + 3H2
Nhôm tác dụng với HNO3 loãng, HNO3 sệt nóng, H2SO4 sệt nóng sinh sản các sản phẩm khử tương ứng.2Al + 6H2SO4 (đặc)→(to) Al2(SO4)3 + 3SO2 + 6H2O
Chú ý: Nhôm bị tiêu cực bởi HNO3đặc nguội, H2SO4 quánh nguội.
3. Tính năng với oxit kim loại
Nhôm khử oxit của kim loại có tính khử yếu hèn hơnAl + Fe2O3 )→(to) Al2O3 + Fe
TQ: Al + M2On →(to) Al2O3 + M
4. Chức năng với nước.
Bề phương diện nhôm gồm lớp oxit bền cấm đoán nước với khí ngấm qua.Phá hủy lớp oxit nhôm fan ta sử dụng Hg để tạo ra hỗn thống (Al – Hg) thì tính năng với nước .2Al + 6H2O → 2Al(OH)3+ 3H2O
5. Chức năng với dung dịch kiềm hóa giải khí H2
2Al + 2Na
OH + 2H2O → 2Na
Al
O2 + 3H2Ó
IV. Trạng thái tự nhiên, sản xuất
Trạng thái trường đoản cú nhiên: tồn tại bên dưới dạng hòa hợp chất
Sản xuất: phương thức là năng lượng điện phân rét chảy nhôm oxit với xúc tác criolit để giảm nhiệt độ nóng chảy tự 2050o
C xuống 900o
C.
2Al2O3 →(đk: to, criolit) 4Al + 3O2
MỘT SỐ HỢP CHẤT quan lại TRỌNG CỦA NHÔM
I. Nhôm oxit (Al2O3)
1. Tính chất
Al2O3 là hóa học rắn, color trắng, không tan vào nước và không tác dụng với nước, t0nc=20500C.
Tính chất hóa học: nhôm oxit là oxit lưỡng tính
Tác dụng với dung dịch axit:Al2O3 + 6HCl → 2Al
Cl3 + 3 H2O
Al2O3 + 2Na
OH → 2Na
Al
O2 + H2O
2. Ứng dụng: cung ứng nhôm, có tác dụng đồ trang sức, xúc tác vào tổng hợp hữu cơ.
II. Nhôm hidroxit - Al(OH)3.
Là hóa học kết tủa keo, color trắng. Ko tan vào nước, trong dd CO2, NH3 cơ mà tan được trong môi trường H+ và OH- mạnh.
Al(OH)3 là hidroxit lưỡng tính.
Xem thêm: Đâu là nguyên nhân của cơn đau đầu khi ngủ dậy là dấu hiệu cảnh báo bệnh lý nào?
Al(OH)3+ 3HCl → Al
Cl3 + 3H2O
Al(OH)3+Na
OH → Na
Al
O2+ 2H2O
III. Nhôm sunfat – Al2(SO4)3
Muối nhôm sunfat khan tan trong nước à tỏa nhiệt vì chưng bị hiđrat hóa.
Phèn chua: K2SO4.Al2(SO4)3.24H2O giỏi viết gọn: KAl(SO4)2.12H2O. Sử dụng trong ngành ở trong da, công nghiệp giấy, chất rứa màu trong ngành dệt vải, làm cho trong nước…
IV. Cách nhận ra ion Al3+ trong dung dịch
Cho từ từ dd Na
OH dư vào dung dịch, nếu như thấy có kết tủa keo xuất hiện thêm rồi rã trong dd Na
OH thì chứng tỏ có ion Al3+: