Axit nitric (HNO3) là trong những dòng hóa chất trông rất nổi bật được ứng dụng thoáng rộng trong đời sống hiện tại. Vậy axit này là gì? cùng Monkey tìm hiểu cấu tạo, tính chất, pha trộn và ứng dụng của axit nitric trong nội dung bài viết dưới đây.
Bạn đang xem: Hno3 là axit mạnh hay yếu

Axit nitric là gì?
Khái niệm: Axit nitric là 1 hợp hóa học vô cơ bao gồm công thức chất hóa học HNO3, được coi là một hỗn hợp nitrat hidro hay còn gọi là axit nitric khan. Axit nitric được hình thành trong tự nhiên, do sấm và sét một trong những cơn mưa sinh sản thành.
Công thức phân tử: HNO3
Cấu sinh sản phân tử:
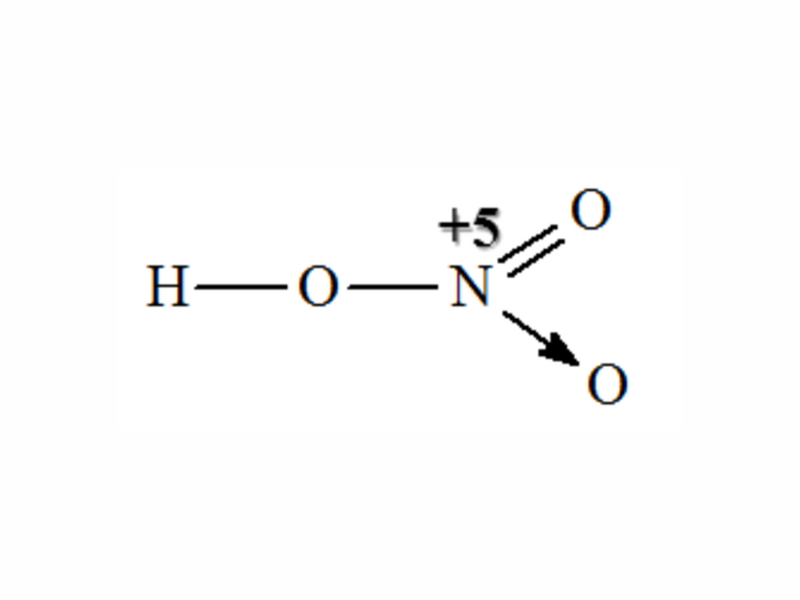
Mũi thương hiệu trong công thức cấu trúc Axit nitric trên cho biết: Cặp electron links chỉ bởi vì nguyên tử nitơ cung cấp.
Trong hợp hóa học HNO3, nitơ bao gồm số oxi hóa tối đa là +5, hóa trị IV.
Tính chất vật lý của axit nitric HNO3
Sau đây là những tính chất vật lý cơ bản của axit nitric (HNO3) mà bạn phải nhớ:
Dạng tồn tại: Axit nitric tinh khiết (tỷ trọng khoảng chừng từ 1522 kg/m3) là chất lỏng không màu, bốc khói mạnh trong không gian ẩm. Dung dịch có hơn 86% axit nitric được call là axit nitric bốc khói. Chúng có thể bốc khói trắng với khói đỏ tùy trực thuộc vào nồng độ của nitơ đioxit. Axit nitric cũng có thể tồn tại sống dạng khí, không màu. Trong môi trường tự nhiên, vị sự tích tụ của nitơ yêu cầu axit nitric tất cả màu vàng nhạt.
Axit cực độc: Axit nitric là một hóa học axit độc có tác dụng ăn mòn và rất dễ gây nên cháy. D= 1.53G/cm3
Kém bền: Axit nitric HNO3 kém bền ngay cả ở điều kiện thường. Hỗn hợp HNO3 sệt phân hủy một phần giải phóng nitơ dioxit NO2 - khí này tan trong hỗn hợp axit, khiến cho dung di chuyển vàng.
4HNO3 → 4NO2 + 2H2O + O2 (ánh sáng khía cạnh trời)
Đây là nguyên nhân cần bảo vệ axit nitric trong những chai, lọ buổi tối màu, tránh tia nắng và bảo đảm an toàn nhiệt độ bên dưới 0°C.
Tan vào nước: Axit nitric tan trong nước theo bất kỳ tỉ lệ nào. (C
Nhiệt độ đông đặc: -42°C
Nhiệt độ sôi: 83°C.
Tính chất hóa học của axit nitric
Axit nitric (HNO3) là một vào những axit cực táo bạo được nhắc tới nhiều nhất trong lĩnh vực hóa học cùng ứng dụng thực tế. Có lẽ rằng bạn vô cùng tò mò về đặc điểm hóa học của loại axit này? Dưới đấy là 3 tính chất hóa học rất nổi bật nhất của HNO3.

Axit nitric là trong số những axit mạnh mẽ nhất
Axit nitric được xếp hạng trong list những axit to gan lớn mật nhất.
Đây là một trong những axit khan - một monoaxit mạnh rất có thể nitrat hóa các hợp chất vô cơ với hằng số cân bằng axit (p
Ka) = -2.
Axit nitric phân li trả toàn thành những ion H+ và NO3- trong dung dịch loãng.
Dung dịch HNO3 có tác dụng quỳ tím chuyển đỏ.
Tác dụng với oxit bazơ, bazơ cùng muối của axit yếu hơn tạo ra muối nitrat.
Ví dụ:
Cu
O + 2HNO3 → Cu(NO3)2 + H2O
Ca
CO3 + 2HNO3 → Ca(NO3)2 + H2O + CO2
Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O
Axit nitric chức năng với oxit bazơ, bazo, muối bột mà kim loại trong hợp chất này chưa lên hóa trị cao nhất:
Ví dụ:
Fe
O + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
Fe
CO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
Axit nitric tất cả tính oxi hóa
Axit nitric cũng là 1 giữa những axit có tính lão hóa mạnh. Nó rất có thể bị khử đến các sản phẩm khác nhau của nitơ, phụ thuộc vào nồng độ axit mạnh hay yếu hèn của chất khử. Cùng mày mò tính thoái hóa của axit nitric thông qua 3 bội nghịch ứng:
Tác dụng cùng với kim loại
Tác dụng với phi kim
Tác dụng với thích hợp chất
Tác dụng với kim loạiAxit nitric có chức năng oxi hóa đa số các kim loại tạo thành muối nitrat, ngay cả kim loại có tính khử yếu hèn (Cu, Ag)..., ngoài Pt cùng Au. Lúc này, sắt kẽm kim loại bị oxi hóa đến mức cao nhất. Sản phẩm của làm phản ứng này vẫn là NO2(+4) so với HNO3 đặc và NO(+2) đối với HNO3 loãng. Nhôm, sắt và crom tiêu cực với axit nitric sệt nguội vị lớp màng oxit bền được chế tạo ra ra đảm bảo an toàn chúng không biến thành oxy hóa tiếp. Đây cũng là tại sao bình nhôm hoặc fe được dùng làm đựng HNO3 đặc.
Phương trình phản nghịch ứng:
Kim nhiều loại + HNO3 sệt → muối bột nitrat + NO + H2O (nhiệt độ)
Kim một số loại + HNO3 loãng → muối nitrat + NO + H2O
Kim nhiều loại + HNO3 loãng lạnh lẽo → muối hạt nitrat + H2
Mg(rắn) + 2HNO3 loãng lạnh → Mg(NO3)2 + H2 (khí)
Ví dụ:
Cu + 4HNO3 sệt → Cu(NO3)2 + 2NO2(↑) + 2H2O
0 +5 +2 +4
3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO (↑) + 4H2O
0 +5 +2 +2
Tác dụng với phi kimKhi được đun nóng, HNO3 đặc có khả năng oxi hóa được các phi kim như S, C, P... (các yếu tố á kim, ko kể halogen với silic). Sản phẩm tạo thành là nito dioxit (nếu là axit nitric đặc) cùng oxit nito (với axit loãng cùng nước).
Ví dụ:
S + 6HNO3 sệt → H2SO4 + 6NO2(↑) + 2H2O (nhiệt độ)
0 +5 +6 +4
C + 4HNO3 quánh → 4NO2 + 2H2O + CO2
P + 5HNO3 sệt → 5NO2 + H2O + H3PO4
3C + 4HNO3 loãng → 3CO2 + 4NO + 2H2O
Tác dụng với phù hợp chấtLà giữa những axit rất mạnh, axit nitric (HNO3) đặc có công dụng oxi hóa - hủy hoại nhiều hợp hóa học vô cơ, hữu cơ không giống nhau.. Vải, giấy, mùn cưa,... Phần lớn bị tiêu diệt hoặc bốc cháy lúc tiếp xúc với HNO3 đặc. Vì chưng vậy, đang vô cùng nguy hại nếu nhằm axit nitric (HNO3) tiếp xúc với khung người người.
Ví dụ:
3H2S + 2HNO3 (>5%) → 3S (↓) + 2NO + 4H2O
Pb
S + 8HNO3 quánh → Pb
SO4(↓) + 8NO2 + 4H2O
HNO3 tổng hợp Ag3PO4, không tính năng với Hg
S.
Cách pha chế axit nitric HNO3
Trong từ bỏ nhiên, axit nitric (HNO3) hiện ra từ những cơn mưa lớn có sét, tạo nên những trận mưa axit. Vậy vào công nghiệp cùng phòng thí nghiệm, đâu là giải pháp điều chế axit nitric?

Điều chế axit nitric trong phòng thí nghiệm
Axit nitric vào phòng nghiên cứu được điều chế bằng cách đun hỗn hợp natri nitrat hoặc kali nitrat rắn cùng với axit sunfuric (H2SO4) đặc cho tới khi còn sót lại chất kết tinh color trắng.
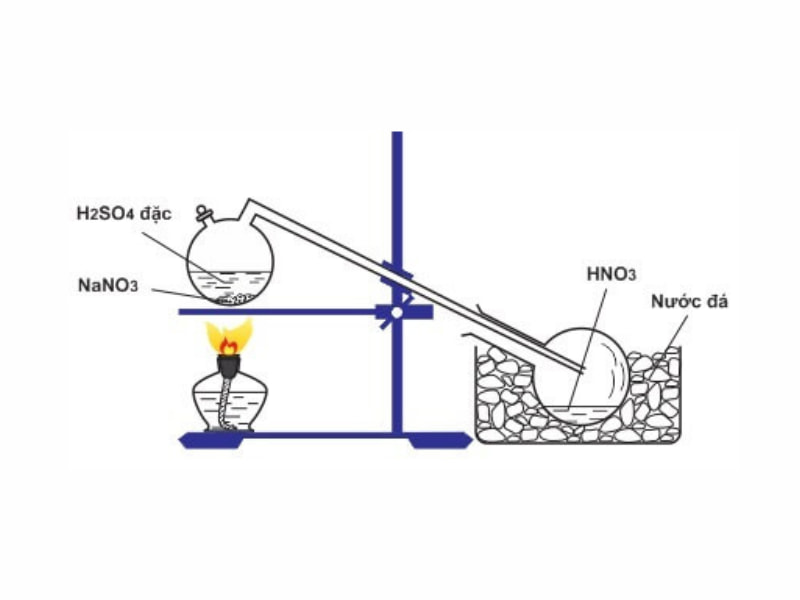
Phương trình: Na
NO3 (tinh thể) + H2SO4 (đặc) → HNO3 + Na
HSO4 (nhiệt độ)
HNO3 thoát ra được dẫn vào bình, làm cho lạnh cùng ngưng tụ. Một chú ý khi thực hiện thí nghiệm: những dụng cụ cần có làm từ chất liệu thủy tinh vì chưng axit nitric khan.
Ngoài ra, axit nitric cũng rất có thể được điều chế trong phòng thí nghiệm bằng phương pháp phân diệt nhiệt của đồng (II) nitrat tạo ra khí nitơ dioxide cùng khí oxy, tiếp nối truyền qua nước để tạo ra axit nitric.
Phương trình như sau:
2Cu(NO3) 2 → 2 Cu
O + 4 NO2 + O2
4 NO2 + O2 → HNO2 + HNO3
3 quy trình tiến độ sản xuất axit nitric vào công nghiệp
Để pha chế axit nitric trong công nghiệp, người ta thực hiện amoniac với 3 giai đoạn:
Giai đoạn 1: oxi hóa khí amoniac thành nitơ monooxit bằng oxi ở ánh sáng 850-900 độ C với chất xúc tác là platin.
4NH3 + 5O2 → 4NO + 6H2O (850-900*C + Pt) (H
Giai đoạn 2: oxi hóa nitơ monooxit thành nitơ dioxit bằng oxi bầu không khí trong điều kiện thường.
2NO + O2 → 2NO2
Giai đoạn 3: mang đến nitơ đioxit chức năng với nước và oxi, tạo nên axit nitric.
4NO2 + O2 + H2O --> 4HNO3
Dung dịch axit nitric thu được gồm nồng độ tự 52 - 68%. Fan ta thường xuyên chưng đựng dung nhờn này cùng H2SO4 đậm sệt để thu được HNO3 cùng với nồng độ cao hơn 68%. Axit nitric công nghiệp thông thường có nồng độ 52% cùng 68%, được thực hiện bằng công nghệ Ostwald do Wilhelm Ostwald sáng chế.
Ứng dụng phổ cập nhất của axit nitric (HNO3) vào thực tiễn
Axit nitric HNO3 được kể đến là 1 axit cực độc với kỹ năng ăn mòn và hủy hoại nhưng không thể không đồng ý những ứng dụng quan trọng đặc biệt của nó trong thực tiễn. Những ứng dụng đó là gì?

Ứng dụng axit nitric trong chống thí nghiệm
Trong phòng thí nghiệm, axit nitric là một tác nhân đặc biệt với vai trò:
Làm thuốc thử: Là dung dịch thử chính được sử dụng trong quá trình nitrat hóa – việc bổ sung cập nhật một team nitro, điển hình là 1 trong những phân tử hữu cơ. Axit nitric cũng hay được thực hiện như một tác nhân oxy hóa mạnh.
Thí nghiệm trên trường học: Axit nitric được sử dụng tại trường học tập để tiến hành các thí nghiệm liên quan đến bài toán thử clorit. Điển hình tốt nhất là mang lại HNO3 tính năng với mẫu thử, sau đó cho dung dịch bạc bẽo nitrat vào để tìm kết tủa trắng của bạc tình clorua.
Ứng dụng axit nitric vào công nghiệp
Axit nitric (HNO3) đóng một vai trò đặc biệt quan trọng trong công nghiệp:
Chế tạo ra thuốc nổ: Axit nitric 68% được thực hiện để sản xuất thuốc nổ gồm những: Nitroglycerin, trinitrotoluen (TNT) và cyclotrimethylenetrinitramine (RDX).
Sản xuất phân bón: Axit nitric cũng khá được dùng để tạo ra các các loại phân bón cất nitơ như: Phân đạm một lá nitrat amoni NH4NO3, muối nitrat như KNO3 , Ca(NO3)2 ,...
Hợp chất nền trong chuyên môn ICP-MS cùng ICP-AES: Axit nitric tất cả nồng độ 0,5-2% được áp dụng làm hợp hóa học nền để xác định trong dung dịch gồm tồn tại sắt kẽm kim loại không. Fan ta gọi đây là kỹ thuật ICP-MS và ICP-AES. Trong chuyên môn này cần thực hiện axit nitric thuần khiết 100% vì một trong những lượng ion kim loại nhỏ tuổi cũng hoàn toàn có thể gây tác động tới công dụng phân tích.
Ứng dụng trong nghề luyện kim, xi mạ, tinh lọc: vày axit nitric phản ứng với phần nhiều các kim loại trong những hợp chất hữu cơ nên nó được ứng dụng thông dụng trong ngành luyện kim, xi mạ và tinh lọc. Khi mang lại HNO3 kết hợp với axit clorua, thu được hỗn hợp nước có chức năng hòa rã bạch kim cùng vàng, được gọi là cường toan.
Sản xuất chất hữu cơ: vào công nghiệp, bạn ta thực hiện axit nitric nhằm sản xuất những chất hữu cơ, các loại bột màu, sơn giỏi thuốc nhuộm vải.
Thuốc tẩy màu: HNO3 còn được sử dụng làm thuốc tẩy màu- colorometric test. Lân cận đó, nó còn giúp phân biệt heroin và morphine.
Chất trung gian sản xuất bọt xốp polyuretan, tua aramit và dược phẩm: HNO3 được dùng để sản xuất nitrobenzen - một tiền hóa học để cung cấp ra anilin, dẫn xuất anilin cùng với những ứng dụng then chốt trong công nghiệp cấp dưỡng dược phẩm, bọt xốp polyuretan, sợi aramit với các thành phầm polyuretan khác ví như chất kết dính, chất bịt kín, chất bọc phủ, chất bọn hồi…
Chất tẩy rửa: Axit nitric được dùng làm chất tẩy rửa các đường ống và mặt phẳng kim loại, được ứng dụng phổ biến trong những nhà vật dụng sữa.
Cân bởi độ tiêu chuẩn chỉnh của nước: Axit nitric còn được sử dụng để vứt bỏ các tạp hóa học và thăng bằng lại độ tiêu chuẩn của nước. Bên cạnh đó, nó còn là 1 trong những chất oxy hóa trong nhiên liệu lỏng thương hiệu lửa.
Những lưu ý quan trọng bạn nên biết khi áp dụng axit nitric
Như họ đã biết, axit nitric HNO3 là 1 trong những axit độc, với quánh tính ăn mòn và dễ dàng bốc cháy. Bởi vì vậy, hãy an toàn khi tiếp xúc với loại axit này. Dưới đó là những xem xét quan trọng bạn phải nhớ.

Tiếp xúc với axit nitric hoàn toàn có thể gây đông đảo tổn mến gì?
Tiếp xúc HNO3 qua mặt đường mắt
Hậu quả: khiến kích ứng rất có thể gây rộp giác mạc và có tác dụng mù lòa.
Cách xử lý: trong trường thích hợp bị axit nitric phun vào mắt, bạn phải dùng nước sạch để rửa đôi mắt ngay lập tức, nháy mắt liên tiếp trong 15 phút. Sau đó, hãy cần sử dụng muối natri clorua 0.9% nhằm rửa lại và tới bệnh viện để được điều trị kịp thời.
Tiếp xúc HNO3 qua đường thở
Hậu quả: khiến kích ứng nghiêm trọng, rất có thể gây cực nhọc thở, dẫn đến viêm phổi cùng tử vong. Một số triệu chứng khác như ho, nghẹt thở, kích ứng mũi…
Cách xử lý: di chuyển đến khu vực thoáng khí, ủ ấm, nằm lặng rồi liên hệ với đại lý y tế gần nhất để khám chữa kịp thời.
Tiếp xúc HNO3 qua đường da
Hậu quả: tạo kích ứng da, mẩn đỏ, đau ngứa và phỏng nặng. Ở độ đậm đặc đậm đặc, nó gây rộp da, khiến da chuyển màu vàng bởi phản ứng với protein keratin.
Cách xử lý: Ngay chớp nhoáng bỏ áo xống bị bám axit, thực hiện khăn thô lau vệt thương, sau đó dùng nước sạch mát (dùng xà phòng nếu như có) rửa lại vết thương nhiều lần. Đưa nạn nhân tới cơ sở y tế để khám chữa kịp thời.
Tiếp xúc HNO3 qua đường tiêu hóa
Hậu quả: Nuốt buộc phải HNO3 hoàn toàn có thể gây cháy miệng, bỏng dạ dày.
Cách xử lý: Hãy tổ hợp Mg
O cùng nước hoặc sữa và lòng trắng trứng rồi đưa nạn nhân tới các đại lý y tế gần nhất để điều trị.
Phơi lan truyền lâu cùng với axit nitric hoàn toàn có thể dẫn cho tới ung thư. Cũng chính vì những hậu quả nghiêm trọng này, khi thao tác cần xúc tiếp với axit nitric, hãy mang dụng cụ bảo hộ lao động an ninh như kính mắt, mũ, khẩu trang, bức xúc tay, quần áo dài tay, giày tất…và liên tiếp giữ không khí làm câu hỏi thông thoáng, không bẩn sẽ.
Lưu ý cần nhớ để đảm bảo bình yên khi tiếp xúc với axit nitric
Axit nitric là 1 trong những chất lão hóa mạnh, hoàn toàn có thể phát nổ khi tính năng với cyanit, bột kim và tự bốc cháy lúc phản ứng cùng với turpentine. Không tính việc chuẩn bị dụng cụ bảo hộ lao đụng an toàn, nhằm đảm bảo an toàn khi tiếp xúc và thực hiện axit nitric, các bạn cần để ý những nguyên tắc sau:
Khi pha loãng HNO3, tuyệt vời và hoàn hảo nhất không được đổ nước vào axit mà nên đổ axit vào nước.
Sử dụng những thùng chứa axit bởi nhựa nỗ lực cho kim loại vì axit nitric công dụng với kim loại.
Các thùng chứa nên tối màu, được bịt nắp cẩn thận, kị xa ánh nắng mặt trời.
Khu vực tàng trữ cần sạch sẽ, loáng mát, kị xa các nguồn nhiệt độ hoặc những vật liệu không tương xứng như: Hợp hóa học hữu cơ, kim loại, rượu…
Nền bên cần hạn chế được axit.
Trong trường hòa hợp hỏa hoạn: nếu như hỏa hoạn xảy ra do axit nitric, bạn cần xử lý bằng phương pháp sử dụng bột khô với bình khí cacbon dioxit nhằm dập lửa. Sau đó, sử dụng dung dịch kiềm để th-nc axit. Dịch rời nhanh chóng các thùng đựng HNO3, hoặc cần sử dụng nước làm cho nguội các thùng này tránh trường hợp phát nổ.
Trong trường vừa lòng axit nitric bị tràn, rò rỉ: Hãy sử dụng đất, cát trùm lên nơi axit bị thất thoát ra. Sau đó, áp dụng soda hoặc Ca(OH)2 khan để trung hòa. Liên tục dùng nước để gia công sạch khoanh vùng hóa chất HNO3 bị rò rỉ.
Bài tập về axit nitric SGK chất hóa học 11 kèm giải mã chi tiết
Để nắm rõ hơn những kỹ năng về axit nitric (HNO3), cùng áp dụng những lý thuyết đã học tập trên nhằm thực hành một số trong những bài tập cơ bạn dạng trong SGK hóa học 11 bên dưới đây.

Giải bài bác 1 trang 45 SGK Hóa 11
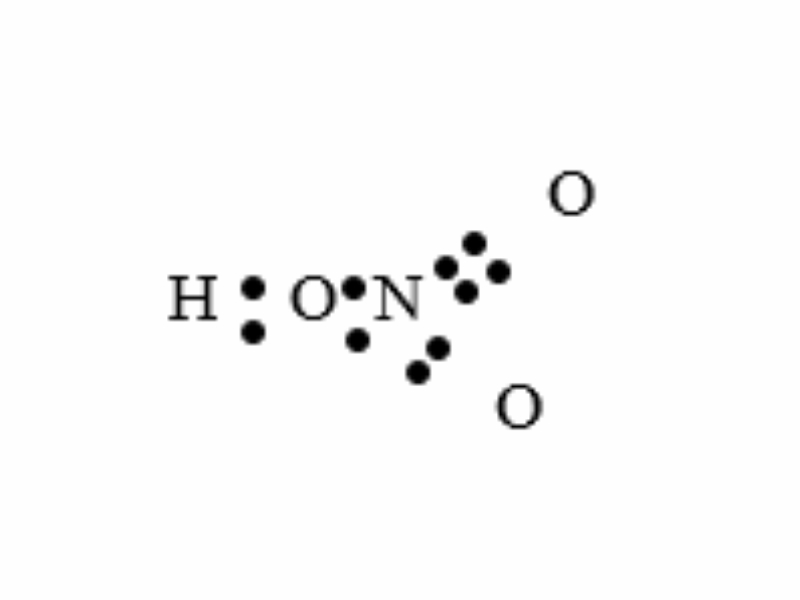
Viết công thức electron cùng công thức cấu trúc của axit nitric. Cho thấy nguyên tố nitơ gồm hoá trị cùng số oxi hoá bằng bao nhiêu?
Lời giải:
Công thức electron:
Công thức cấu tạo:
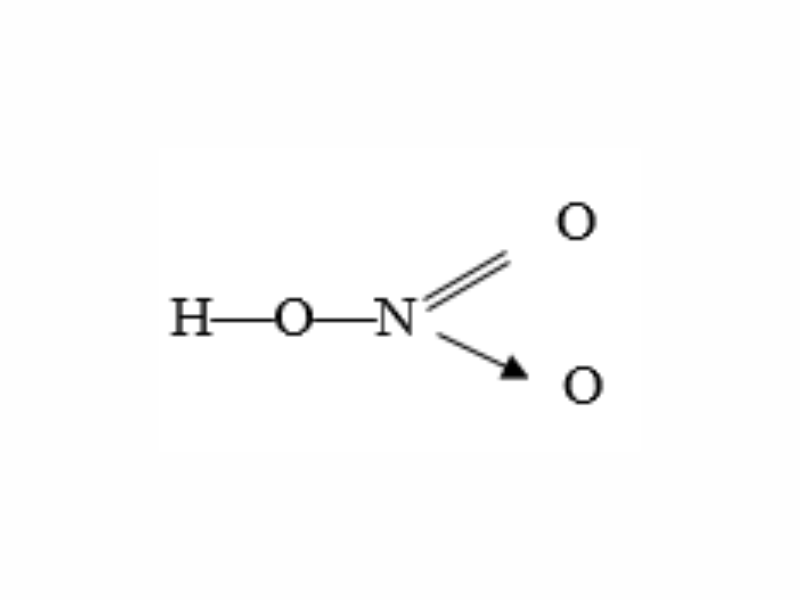
Nguyên tố nitơ tất cả hoá trị 4 với số oxi hoá +5
Giải bài bác 2 SGK Hóa 11 trang 45
Lập những phương trình hoá học:
a. Ag + HNO3 (đặc) → NO2 ↑ + ? + ?
b. Ag + HNO3 (loãng) → NO ↑ + ? + ?
c. Al + HNO3 → N2O ↑ + ? + ?
d. Zn + HNO3 → NH4NO3 + ? + ?
e. Fe
O + HNO3 → NO ↑ + Fe(NO3)3 + ?
f. Fe3O4 + HNO3 → NO ↑ + Fe(NO3)3 + ?
Lời giải:
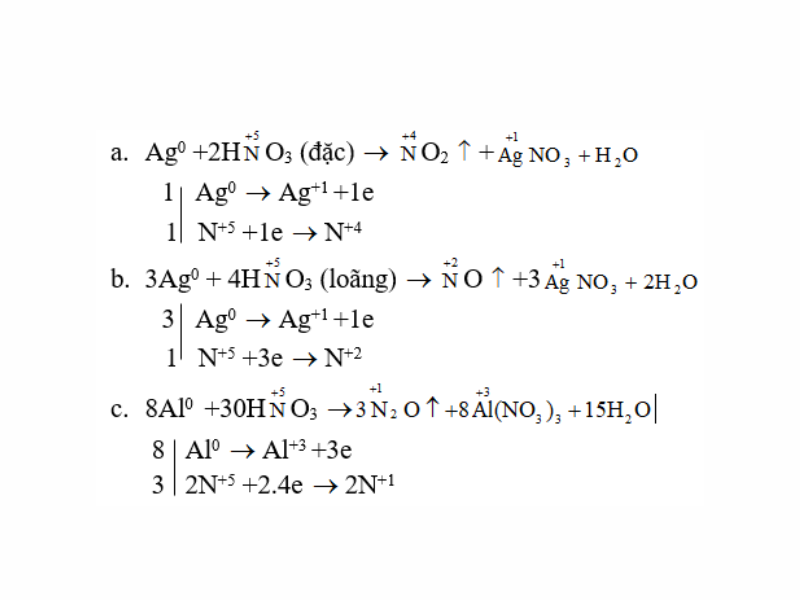
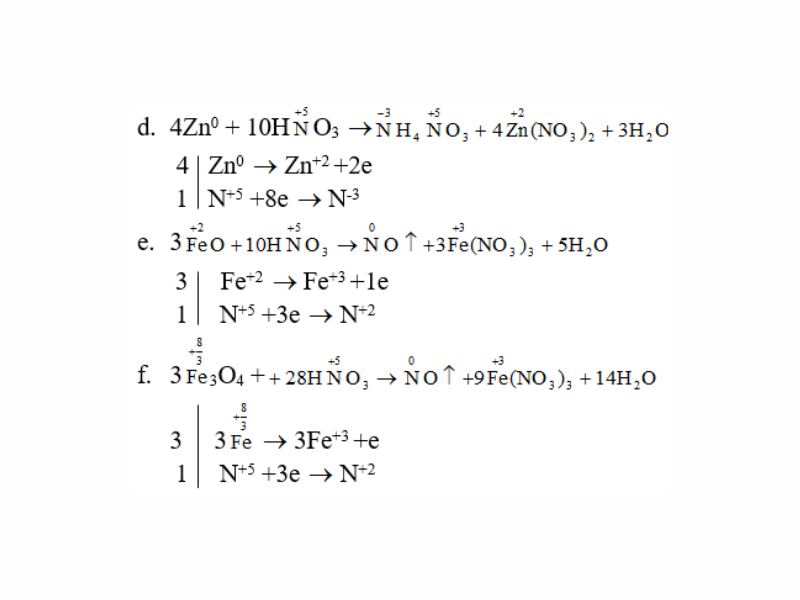
Giải bài 3 SGK trang 45 Hóa 11
Hãy chỉ ra rằng những đặc điểm hoá học tầm thường và khác biệt giữa axit nitric và axit sunfuric. Viết những phương trình hoá học nhằm minh hoạ?
Lời giải:
Tính hóa học khác biệt:
Axit H2SO4 loãng có tính axit, H2SO4 đặc có tính oxi hoá mạnh, còn axit HNO3 dù là axit sệt hay loãng đề gồm tính oxi hoá mạnh khi tính năng với những chất bao gồm tính khử.
H2SO4 loãng không chức năng được với các kim các loại đứng sau hidro trong dãy hoạt động hoá học như axit HNO3.
Fe + H2SO4 (loãng) → Fe
SO4 + H2↑
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Tính chất chung:
H2SO4 loãng cùng HNO3 đều có tính axit mạnh
Ví dụ:
Đổi màu chất chỉ thị: Quỳ tím gửi thành color hồng
Tác dụng với bazơ, oxit bazơ không tồn tại tính khử (các nguyên tố có số oxi hoá cao nhất):
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3+ 6H2O
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
2HNO3 + Ca
CO3 → Ca(NO3)2 + H2O + CO2↑
H2SO4 + Na2SO3 → Na2SO4 + H2O + SO2↑
H2SO4(đặc) cùng axit HNO3 đều có tính oxi hoá mạnh
Ví dụ:
Tác dụng được với hầu như các kim loại (kể cả kim loại đứng sau hiđro vào dãy vận động hoá học) và đưa kim loại lên số oxi hoá cao nhất.
Fe + 4HNO3 → Fe(NO3)3 + NO↑ + 2H2O
Cu + 2H2SO4(đặc) → Cu
SO4 + SO2↑ + 2H2O
Tác dụng với một số trong những phi kim (đưa phi kim lên số oxi hoá cao nhất)
C + 2H2SO4(đặc) → CO2↑ + 2SO2↑ + 2H2O
S + 2HNO3 → H2SO4 + 2NO↑
Tác dụng cùng với hợp chất (có tính khử)
3Fe
O + 10HNO3 → 3Fe(NO3)3 + NO↑ + 5H2O
2Fe
O + 4H2SO4(đặc) → Fe2(SO4)3 + SO2↑ + 4H2O
Cả nhì axit khi làm cho đặc nguội rất nhiều làm Fe và Al bị bị động hoá (có thể dùng bình làm bằng nhôm cùng sắt để đựng axit nitric với axit sunfuric đặc)
Giải bài xích 7 Hóa lớp 11 trang 45 SGK
Để điều chế được 5,000 tấn axit nitric nồng độ 60,0% đề xuất dùng từng nào tấn amoniac? hiểu được sự hao hụt amoniac trong quá trình sản xuất là 3,8%.
Lời giải:
Khối lượng HNO3 nguyên hóa học là: 5.60/ 100 = 3 tấn
Sơ đồ vật phản ứng pha trộn HNO3 từ NH3:
NH3 → NO → NO2 → HNO3
1mol ← 1mol
17g 63g
x tấn 3 tấn
Theo sơ đồ trên, n(HNO3) = m(NH3)
→ m(NH3) = 3/63 x 17 = 0.809524 tấn
Khối lượng NH3 hao hụt là 3.8% → công suất đạt: 100 - 3.8 = 96.2%
Vì vậy, trọng lượng amoniac đề nghị dùng là: 0.809524/ 96.2% = 0.8415 tấn
Trên đấy là những kỹ năng cơ phiên bản và đặc trưng nhất mà chúng ta cần ghi lưu giữ khi tò mò về axit nitric (HNO3). Hy vọng bài viết giúp bạn nắm chắc những thông tin về nhiều loại axit phổ cập này và hoàn toàn có thể áp dụng nó vào các bài tập Hóa học cũng tương tự thực tiễn đời sống. Chúc bạn có một quy trình học tập công dụng và nhớ là chia sẻ bài viết nếu thấy gồm ích.
Axit nitric và công thức cấu trúc là gì? đặc thù vật lý của HNO3? đặc điểm hóa học tập của HNO3? Điều chế và ứng dụng HNO3? Những xem xét khi áp dụng HNO3? bài tập về HNO3?
Axit Nitric – HNO3 là gì? Đặc tính Lý hóa của Axit nitric – HNO3 như thế nào? Và quy trình điều chế axit nitric HNO3 cũng như Ứng dụng của axit nitric vào thực tiễn. Mặt cạnh đó, liệu axit nitric có độc hại xuất xắc không, giải pháp xử lý sự cố vì chưng axit nitric gây nên và Những để ý khi áp dụng axit nitric.
3 3. Tính chất hóa học của HNO3: 4 4. Điều chế và ứng dụng HNO3: 5 5. Những để ý khi áp dụng HNO3: 6 6. Bài bác tập về HNO3:
1. Axit nitric với công thức cấu trúc là gì?
Axit nitric là hợp chất vô cơ bao gồm công thức hóa học HNO3 – được coi làm một hỗn hợp nitrat hidro hay còn được gọi là axit nitric khan. Các loại axit này được hình thành trong từ bỏ nhiên, do một trong những cơn mưa bởi vì sấm và sét sản xuất thành. Axit nitric tinh khiết là chất lỏng ko màu, bốc khói bạo phổi trong ko khí độ ẩm và là một hóa học axit độc và bào mòn và rất dễ gây cháy.
Nếu một dung dịch tất cả hơn 86% axit nitric, nó được gọi là axit nitric bốc khói. Axit nitric bốc sương có đặc thù axit nitric bốc khói trắng với axit nitric bốc khói đỏ, tùy ở trong vào số lượng nitơ đioxit hiện tại diện.
Công thức cấu trúc của HNO3:
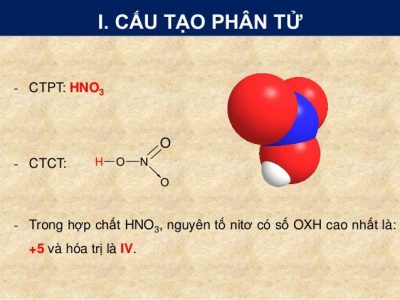
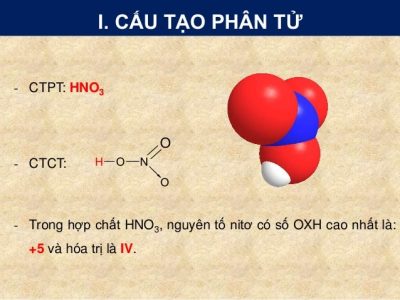
2. đặc thù vật lý của HNO3:
HNO3 có đặc thù vật lý như sau:
– Axit nitric tinh khiết là một trong những chất lỏng không màu với trong suốt, nhưng axit nitric đậm đặc lại sở hữu màu quà nhạt.
– Nó tất cả mùi khó chịu ngột ngạt.
– khối lượng mol: 63,01214 g/mol (khan) ;81,02742 g/mol ( ngậm 1 nước) và 117,05798 g/mol ( ngậm 3 nước).
– ánh nắng mặt trời sôi: 83°C (181°F; 356 K).
– nhiệt độ nóng chảy: −42°C (−44°F; 231 K).
– tan trong nước theo bất kì tỉ lệ nào.
– Axit nitric được áp dụng và thường chạm chán nhất là sống nồng độ 68%.
– Cần bảo quản HNO3 trong số chai lọ buổi tối màu, tránh khu vực có ánh nắng và bảo quản ở nhiệt độ dưới 0 độ C.
– Axit nitric rất có thể hòa rã nito dioxit thành dung dịch tất cả màu vàng hoặc đỏ ở ánh sáng cao. Điều này tác động không nhỏ đến các đặc trưng đồ lý của hóa học này, nhất là áp suất tương đối trên hóa học lỏng, màu sắc dung dịch, nhiệt độ sôi,… dựa vào vào độ đậm đặc NO2.
– khi chưng cất các thành phần hỗn hợp HNO3 cùng H2O ta thu nhận được azeotrope có nồng độ 68% HNO3 cùng sôi làm việc 120,5 độ C, 1atm.
3. đặc thù hóa học của HNO3:
3.1. Axit nitric là giữa những axit to gan lớn mật nhất:
Axit nitric được xếp hạng trong list những axit táo bạo nhất. Đây là 1 trong axit khan – một monoaxit mạnh rất có thể nitrat hóa nhiều hợp chất vô cơ cùng với hằng số cân bằng axit (p
Ka) = -2.
Axit nitric phân li hoàn toàn thành các ion H+ và NO3- trong dung dịch loãng. Hỗn hợp HNO3 có tác dụng quỳ tím gửi đỏ.
HNO3 có tác dụng với oxit bazơ, bazơ cùng muối của axit yếu ớt hơn tạo ra muối nitrat.
Ví dụ:
Cu
O + 2HNO3 → Cu(NO3)2 + H2O
Ca
CO3 + 2HNO3 → Ca(NO3)2 + H2O + CO2
Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O
Axit nitric tính năng với oxit bazơ, bazo, muối bột mà sắt kẽm kim loại trong hợp hóa học này không lên hóa trị cao nhất:
Ví dụ:
Fe
O + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
Fe
CO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
3.2. Axit nitric tất cả tính oxi hóa:
Axit nitric cũng chính là 1 trong những axit tất cả tính lão hóa mạnh. Nó rất có thể bị khử đến các sản phẩm không giống nhau của nitơ, phụ thuộc vào mật độ axit mạnh khỏe hay yếu của hóa học khử. Cùng khám phá tính thoái hóa của axit nitric thông qua 3 bội phản ứng:
Một là,Tác dụng với kim loại
Hai là, công dụng với phi kim
Ba là, chức năng với hòa hợp chất
Tác dụng với kim loại
Axit nitric có khả năng oxi hóa đa số các kim loại tạo ra muối nitrat, trong cả kim loại tất cả tính khử yếu ớt (Cu, Ag)…, kế bên Pt với Au. Dịp này, kim loại bị oxi hóa đến hơn cả cao nhất. Thành phầm của phản nghịch ứng này đang là NO2(+4) đối với HNO3 đặc và NO(+2) đối với HNO3 loãng. Nhôm, sắt cùng crom bị động với axit nitric sệt nguội vị lớp màng oxit bền được sinh sản ra bảo đảm chúng không xẩy ra oxy hóa tiếp. Đây cũng là nguyên nhân bình nhôm hoặc sắt được dùng làm đựng HNO3 đặc.
Phương trình làm phản ứng:
Kim nhiều loại + HNO3 sệt → muối bột nitrat + NO + H2O (nhiệt độ)
Kim loại + HNO3 loãng → muối nitrat + NO + H2O
Kim nhiều loại + HNO3 loãng giá → muối nitrat + H2
Mg(rắn) + 2HNO3 loãng lạnh lẽo → Mg(NO3)2 + H2 (khí)
Ví dụ:
Cu + 4HNO3 sệt → Cu(NO3)2 + 2NO2(↑) + 2H2O
3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO (↑) + 4H2O
Tác dụng cùng với phi kim
Khi được đun nóng, HNO3 đặc có công dụng oxi hóa được những phi kim như S, C, P… (các yếu tắc á kim, ngoại trừ halogen cùng silic). Sản phẩm tạo thành là nito dioxit (nếu là axit nitric đặc) cùng oxit nito (với axit loãng và nước).
Ví dụ:
S + 6HNO3 quánh → H2SO4 + 6NO2(↑) + 2H2O (nhiệt độ)
C + 4HNO3 quánh → 4NO2 + 2H2O + CO2
P + 5HNO3 sệt → 5NO2 + H2O + H3PO4
3C + 4HNO3 loãng → 3CO2 + 4NO + 2H2O
Tác dụng với hòa hợp chất
Là trong số những axit cực mạnh, axit nitric (HNO3) đặc có chức năng oxi hóa – phá hủy nhiều hợp hóa học vô cơ, hữu cơ khác nhau.. Vải, giấy, mùn cưa,… đa số bị phá hủy hoặc bốc cháy lúc tiếp xúc với HNO3 đặc. Vì vậy, đang vô cùng nguy hại nếu nhằm axit nitric (HNO3) tiếp xúc với khung người người.
Ví dụ:
3H2S + 2HNO3 (>5%) → 3S (↓) + 2NO + 4H2O
Pb
S + 8HNO3 đặc → Pb
SO4(↓) + 8NO2 + 4H2O
HNO3 tổ hợp Ag3PO4, không công dụng với Hg
S.
4. Điều chế và ứng dụng HNO3:
4.1. Điều chế HNO3:
Trong môi trường xung quanh phòng thí nghiệm
Ở môi trường thiên nhiên phòng thí nghiệm, bạn ta thường đến muối Natri dạng tinh thể kết hợp tính năng với H2(SO4) đặc. Sau đó sẽ bác bỏ cất tất cả hổn hợp này tại ánh nắng mặt trời sôi của chủ yếu Axit HNO3 là 83 độ C. Sau cuối sau lúc chưng cất, HNO3 sẽ sót lại đó là một trong hợp chất kết tủa màu trắng có phương trình hóa học kia là:
H2SO4 sệt + Na
NO3 (tinh thể) → HNO3 + Na
HSO4
Axit Nitric sau khi bốc khói đỏ sẽ mau lẹ chuyển sang dạng hợp hóa chất Axit Nitric màu trắng. để ý khi thực hiện các thí nghiệm, chúng ta nên làm bằng các dụng nạm thủy tinh, quan trọng nên sử dụng các loại bình cổ cong nguyên khối bởi vì Axit Nitric khan.
Trong môi trường thiên nhiên sản xuất chất hóa học công nghiệp
Axit Nitric (loãng) có thể được điều chế bằng phương pháp cô đặc mang đến 68% axit hỗn hợp Azeotropic với khoảng 32% là nước. Để thu được axit tất cả nồng độ cao hơn, bọn họ sẽ tiến hành chưng cất HNO3 cùng với hợp hóa học dung dịch axit H2SO4 (axit sunfuric).
H2So4 vẫn đóng vai trò như một chất khử mạnh, nó đã hấp thụ lại H2O. Với phương trình hóa học ví dụ như sau:
4NH3 + 5O2 → 4NO + 6H2O (Pt, 850o
C)
2NO + O2 → NO2
4NO2 + O2 + 2H2O → 4HNO3
Dung dịch axit Nitric pha chế ở điều kiện công nghiệp sẽ sở hữu nồng độ là 52% và 68%. Vấn đề sản xuất Axit Nitric được thực hiện và điều chế hoàn toàn bằng technology Ostwald bởi vì Wilhelm Ostwald vạc minh.
4.2. Ứng dụng HNO3:
Trong phòng thí nghiệm
Axit nitric là thuốc thử bao gồm được thực hiện cho quá trình nitrat hóa – việc bổ sung cập nhật một nhóm nitro, điển hình là 1 phân tử hữu cơ. Và nó cũng thường xuyên được áp dụng như một tác nhân oxy hóa mạnh.
Axit nitric cũng rất được sử dụng vào phòng phân tích trường học tập để triển khai các thí nghiệm tương quan đến bài toán thử clorit. Cho axit nitric (HNo3) tính năng với mẫu thử, sau đó cho dung dịch bạc nitrat vào để tìm kết tủa trắng của bạc bẽo clorua.
Trong chất hóa học công nghiệp
Axit Nitric mật độ 68% được có sử dụng để sở hữu thể chế tạo ra các loại thuốc nổ cơ phiên bản như TNT hay như là cyclotrimethylenetrinitramin (RDX).
Axit nitric có nồng độ 0,5-2% được thực hiện làm hợp hóa học nền nhằm xác minh trong dung dịch bao gồm tồn tại sắt kẽm kim loại không. Bạn ta gọi đó là kỹ thuật ICP-MS với ICP-AES.
Người ta còn thực hiện Axit Nitric để tiếp tế ra các hợp chất hữu cơ, bột màu, các loại dung dịch nhuộm vải vóc và hóa học tẩy màu.
Axit nitric được dùng để làm sản xuất nitrobenzen – tiền chất để cấp dưỡng anilin và các dẫn xuất anilin cùng với những vận dụng then chốt trong sản xuất bọt bong bóng xốp polyuretan, sợi aramid cùng dược phẩm.
Ở điều kiện nồng độ chất hóa học thấp (khoảng 10%) axit nitric thường đã được dùng để làm nhân chế tạo thông và maple. Màu sắc khi được tạo ra nhờ phản ứng sẽ sở hữu một color khá kiểu như màu vàng xám loại như màu mộc cũ hoặc gỗ vẫn thành phẩm.
HNO3 còn được sử dụng làm những loại hóa học tẩy rửa đường ống, tẩy rửa mặt phẳng kim các loại có trong các nhà máy sản xuất sữa.
Axit Nitric được dùng để thải trừ các tạp chất, có công dụng cân bởi lại cường độ tiêu chuẩn chỉnh của H2O.
Sử dụng để điều chế các loại phân bón hóa học, phân đạm, các loại muối bột nitrate ngành phân bón như: KNO3, Ca(NO3)2,..
5. Những chú ý khi sử dụng HNO3:
5.1. Rất nhiều tổn thương khi tiếp xúc:
– tiếp xúc theo mặt đường mắt: tạo kích ứng rất có thể gây phỏng làm mù lòa.
– xúc tiếp theo đường thở: gây kích ứng nghiêm trọng. Hít phải rất có thể gây nghẹt thở và dẫn mang lại viêm phổi cùng tử vong. Triệu chứng khác gồm những: Ho, nghẹt thở, kích ứng mũi và con đường hô hấp.
– tiếp xúc theo con đường da: gây kích ứng, mẩn đỏ, đau và bỏng nặng.
– tiếp xúc theo mặt đường tiêu hóa: giả dụ nuốt phải có thể gây cháy miệng, dạ dày.
– Phơi truyền nhiễm lâu có thể dẫn tới ung thư.
5.2. Giải pháp xử lý sự cố bởi HNO3 khiến ra:
– Hít phải: kiếm tìm kiếm bầu không khí trong lành và âu yếm y tế ngay lập tức.
– xúc tiếp mắt: ngay chớp nhoáng rửa mắt bởi nhiều nước trong ít nhất 15 phút để ngăn ngừa tổn thương thêm, tiếp đến lập tức tìm kiếm sự âu yếm y tế.
– tiếp xúc với da: ngay lập tức rửa sạch sẽ vùng bị ảnh hưởng với các nước trong ít nhất 15 phút. đào thải quần áo bị độc hại và rửa bằng xà bông. âu yếm y tế ngay mau lẹ khi được yêu thương cầu.
– Nuốt phải: súc miệng bằng nước hoặc sữa. Chú ý rằng không được phép cho bất cứ thứ gì vào mồm của nàn nhân khi bọn họ đã chết giả để tránh hồ hết trường phù hợp kích ứng. Search kiếm sự quan tâm y tế nhanh nhất có thể có thể.
5.3. Những lưu ý khi sử dụng:
– Axit nitric có tính oxy hóa và làm mòn ở cả hỗn hợp đậm đặc và loãng phải rất nguy hiểm cho bé người, bắn vào da, mắt hoàn toàn có thể gây bỏng nặng. Sau khi da tiếp xúc với axit nitric đã từ từ gửi sang màu sắc vàng, sau cuối lớp biểu bì bị ố tiến thưởng sẽ bong rơi (do axit nitric và protein xúc tiếp sẽ tạo ra phản ứng xanthin và đổi mới tính).
– Hít đề nghị khí của axit nitric lỏng hoàn toàn có thể gây kích ứng con đường hô hấp và có thể gây phù phổi cấp tính. Nếu như uống nhầm chất hóa học này gây sôi bụng dữ dội. Trong trường đúng theo nghiêm trọng, rất có thể gây thủng dạ dày, co thắt thanh quản, tổn thương thận, sốc với ngạt thở.
– Axit nitric đậm đặc cần phải đựng trong chai chất thủy tinh sẫm màu nhằm tránh bội phản ứng với tia nắng giải phóng NO2 độc hại.
– bảo quản HNO3 trong kho mát, thông gió. Kị xa lửa với nguồn nhiệt. Nhiệt độ độ bảo vệ không vượt vượt 30 ℃ cùng độ ẩm tương đối không vượt vượt 80%, bình chứa cần đậy nắp kín. Nó yêu cầu được bảo vệ riêng biệt với những chất khử, kiềm, và sắt kẽm kim loại kiềm.
6. Bài xích tập về HNO3:
6.1. Dạng 1 Kim loại chức năng với HNO3:
Bài 1. Hoà tan trọn vẹn 1,2 gam kim loại X vào hỗn hợp HNO3 dư nhận được 0,224 lít khí nitơ độc nhất (đktc). Xác định kim các loại X?
Bài 2. phối hợp 16,2 gam kim loại hoá trị III vào 5 lít hỗn hợp HNO3 0,5 M (D = 1,25 g/ml). Sau thời điểm phản ứng xong thu được 2,8 lit tất cả hổn hợp khí X có NO, N2 (0o
C, 2 atm). Trộn các thành phần hỗn hợp khí X cùng với lượng oxi vừa đủ sau phản nghịch ứng thấy thể tích khí chỉ bằng 5/6 tổng thể và toàn diện tích X với oxi new cho vào.
Bài 3. Hoà tan trọn vẹn 17.28 gam Mg vào dung dịch HNO3 0,1M thu được dung dịch A cùng 1,344 lít hỗn hợp khí X bao gồm N2 và N2O (ở 00C, 2 atm). Thêm một lượng dư KOH vào dung dịch A, đun nóng thì bao gồm một khí bay ra. Khí này tác dụng vừa đủ với 200 ml hỗn hợp H2SO4 0,1 M. Tính thể tích từng khí trong hỗn hợp X.
6.2. Dạng 2 kim loại phản ứng với hỗn hợp HNO3 cùng H2SO4:
Bài 1: mang đến 3,2 gam bột Cu chức năng với 100 ml dung dịch hỗn hợp bao gồm HNO3 0,8 M và H2SO4 0,2 M. Sau thời điểm phản ứng trả toàn, sinh ra V lít khí NO (sản phẩm khử độc nhất vô nhị đktc). Tìm giá trị của V?
Bài 2: Hoà tan hoàn toàn m gam hỗn hợp X (Cu, Ag) vào dung dịch cất HNO3 với H2SO4 thu được hỗn hợp Y đựng 7,06 gam muối và các thành phần hỗn hợp khí Z đựng 0,05 mol NO2 với 0,01 mol SO2. Quý giá của m là?
Bài 3: mang đến 12,9 gam các thành phần hỗn hợp Al với Mg bội nghịch ứng với 100 ml dung dịch tất cả hổn hợp HNO3 cùng H2SO4 nhận được 0,1 mol mối khí SO2, NO, N2O. Cô cạn hỗn hợp thu được sau làm phản ứng được từng nào gam muối bột khan?
6.3. Dạng 3 chứng tỏ tính oxi hoá của NO3- – sắt kẽm kim loại phản ứng với muối nitrat trong môi trường axit:
Bài 1. Cho một lượng Cu2S chức năng hoàn toàn với dung dịch HNO3 đun nóng. Phản bội ứng chế tạo ra thành dung dịch A1 và làm cho giải phóng ra khí A2 không màu, bị hoá nâu trong không khí. Phân chia A1 thành nhị phần. Thêm hỗn hợp Ba
Cl2 vào phần 1, thấy chế tạo ra thành kết tủa white A3 không tan vào axit dư. Thêm lượng dư hỗn hợp NH3 vào phần hai bên cạnh đó khuấy hầu như hỗn hợp, thu được dung dịch A4 có màu xanh da trời đậm.
Bài 2. cho 19,2 g Cu vào 500 ml hỗn hợp Na
NO3 1M, tiếp nối thêm 500 ml hỗn hợp HCl 2M được hỗn hợp A
OH 0,2 M để kết tủa hết Cu2+chứa trong dung dịch A.
Bài 3. Hoà chảy 26,88 gam bột sắt kẽm kim loại đồng trong dung dịch HNO3 loãng. Sau khi ngừng phản ứng, có 4,48 lít khí NO (đktc) thoát ra và còn lại m gam hóa học không tan. Thêm tiếp thong dong V ml dung dịch HCl 3,2 M vào nhằm hoà tan vừa không còn m gam chất không tan, bao gồm khí NO bay ra (duy nhất). Khẳng định trị số của V?
6.4. Dạng 4 việc tổng đúng theo axit nitric công dụng với kim loại:
Bài 1. so sánh thể tích khí NO (duy nhất) thoát ra trong 2 xem sét sau (các khí đo trong cùng điều kiện):
TN1: mang lại 3,84 gam Cu bội phản ứng với 80 ml hỗn hợp HNO3 1,0 mol/lít.
TN2: mang đến 3,84 gam Cu làm phản ứng với 80 ml dung dịch chứa HNO3 1,0 mol/lít cùng H2SO4 0,5 mol/lít.
Xem thêm: Bệnh Viêm Gan B Có Nguy Hiểm Không? Chuyên Gia Chia Sẻ Khiến Bạn Bất Ngờ
Bài 2. Nung x mol sắt trong không khí một thời gian thu được 16,08 gam hỗn hợp H gồm 4 hóa học rắn có Fe cùng 3 oxit của nó. Kết hợp hết lượng các thành phần hỗn hợp H trên bởi dung dịch HNO3 loãng, thu được 672 ml khí NO độc nhất vô nhị (đktc). Khẳng định trị số của x?
Bài 3. Mang lại 13,6 gam hỗn hợp Fe, Fe
O, Fe2O3 với Fe3O4 phản ứng không còn với dung dịch HNO3 loãng (dư), chiếm được 1,344 lít khí NO (sản phẩm khử duy nhất, làm việc đktc) cùng dung dịch X. Cô cạn X thu được từng nào gam muối bột khan?