Chiếm tới 49.4% trọng lượng của vỏ Trái Đất, oxi được coi là nguyên tố hóa học phổ biến. Đây cũng là ngôn từ chương trình học đặc biệt trong công tác Hóa học cả cấp trung học cơ sở và THPT. Nội dung bài viết dưới đây đang giúp chúng ta tổng hợp phần nhiều kiến thức đặc trưng về tính chất, cách điều chế cũng giống như những ứng dụng quan trọng của yếu tố này trong cuộc sống.
Bạn đang xem: Công thức hóa học của đơn chất khí oxi là
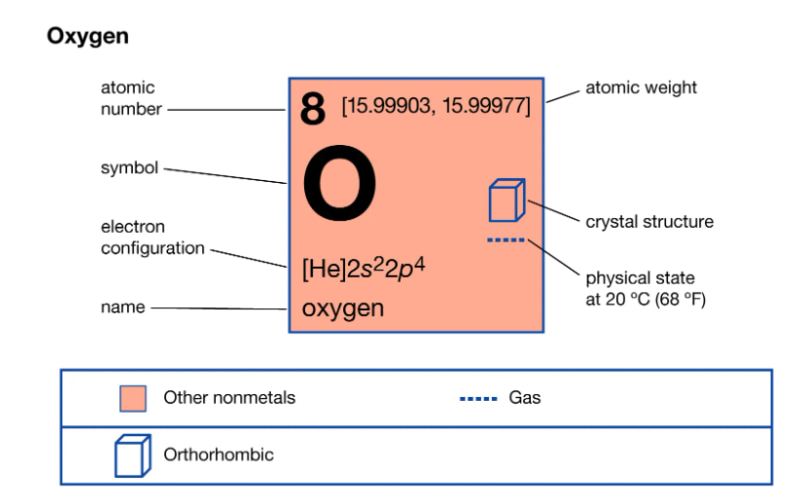
Oxi gồm số hiệu nguyên tử là 8, thuộc đội VIA, chu kì 2 của bảng tuần hoàn những nguyên tố hóa học.
Nguyên tử oxi có cấu hình electron là 1s22s22p4, lớp ngoài cùng gồm 6e. Ở trong điều kiện bình thường, phân tử oxi tất cả 2 nguyên tử link với nhau bằng links cộng hóa trị ko cực hoàn toàn có thể viết công thức cấu tạo phân tử oxi là O=O.
Tính hóa học vật lý của oxi
Để hiểu rõ những đặc thù vật lý của khí oxi, SGK hóa học 8 (NXB giáo dục và đào tạo Việt Nam) đã gửi ra trường hợp quan sát tương tự như những thắc mắc gợi mở kỹ năng để các bạn hình dung ví dụ hơn.

Quan sát: Có 1 lọ đựng khí oxi được đậy nút. Trọng trách của bạn học là dấn xét màu sắc của khí oxi. Tiếp đó mở nút của lọ đó, đưa lên gần mũi và cần sử dụng tay phẩy dịu khí oxi vào mũi để dấn xét mùi của nó.
2 thắc mắc tiếp theo được chỉ dẫn để tìm hiểu tính hóa học của oxi là:
1 lít nước ở đôi mươi độ C phối hợp được 31 ml khí oxi. Có chất khí (ví dụ amoniac) chảy được 700 lít trong một lít nước. Vậy khí oxi là chất tan các hay ít trong nước?
Xác định khí oxi nặng nề hay nhẹ hơn không khí? (Cho biết tỉ khối của oxi đối với không khí là 32 : 29).
Sau khi trả lời được những thắc mắc và quan sát ở trên, ta hoàn toàn có thể dễ dàng kết luận những đặc thù vật lý điển hình của khí oxi là:
Khí oxi là hóa học khí không màu, ko mùi, không vị và nặng hơn không khí (d= 32/29, dao động bằng 1.1).
Dưới áp suất khí quyển thoái hóa lỏng ở ánh sáng -183 độ C.
Khí oxi không nhiều tan không nhiều trong nước, 100ml nước ở 20 độ C, 1 atm tổng hợp được 3.1ml khí oxi.
Độ tan của khí oxi ở đôi mươi độ C với 1 atm là 0.0043g trong 100g H2O.
Tính hóa chất của oxi
Tìm gọi về oxi không thể bỏ qua những tính chất hóa học cơ phiên bản của nó. Chú ý chung, oxi là 1 trong đơn hóa học phi kim siêu hoạt động, đặc biệt quan trọng ở ánh sáng cao, dễ dàng tham gia bội phản ứng hóa học với rất nhiều phi kim, những kim loại cũng như hợp chất. Trong số hợp chất hóa học nguyên tố oxi bao gồm hóa trị II.
Oxi tính năng với kim loại
SGK hóa học 8 đã đưa ví dụ là 1 trong thí nghiệm để chứng minh oxi tất cả thể chức năng với sắt kẽm kim loại như sau:
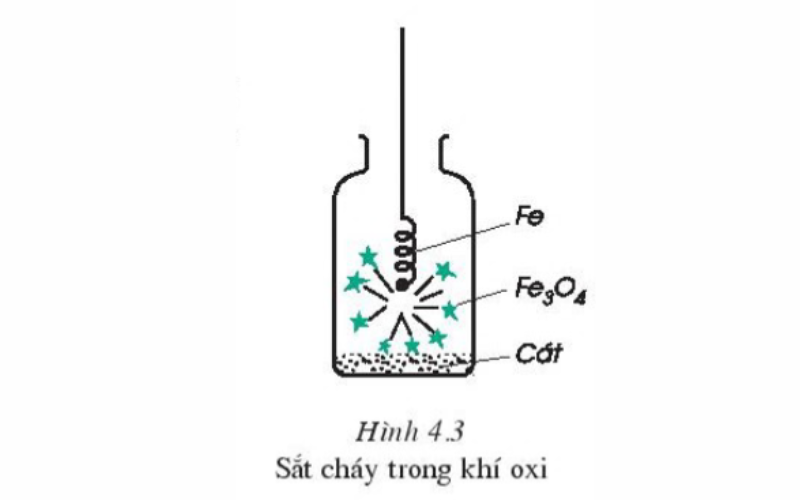
Lấy một quãng dây sắt nhỏ đưa vào lọ đựng khí oxi. Quan cạnh bên thí nghiệm nhằm xem gồm phản ứng chất hóa học nào xảy ra không. Liên tiếp quấn sản xuất đầu dây fe một mẩu than gỗ, đốt cho sắt với than lạnh đỏ rồi đưa vào lọ đựng khí oxi. Qua quan tiền sát bạn cũng có thể rút ra nhấn xét: Khi mang lại dây sắt tất cả quấn mẩu than hồng vào lọ khí oxi, mẩu than cháy trước tạo nhiệt độ đủ cao mang đến sắt cháy. Fe cháy mạnh, sáng sủa chói không có ngọn lửa, không tồn tại khói, tạo nên các hạt nhỏ nóng chảy màu nâu là fe (II, III) oxit, phương pháp hóa học là Fe3O4 (oxit fe từ).
Phương trình hóa học xảy ra như sau:
3Fe (r) + 2O2 (k) → Fe3O4 (Điều kiện: nhiệt độ)
Ví dụ khác: Mg + O2 → 2Mg
O (Điều kiện: nhiệt độ)
Oxi tác dụng với phi kim
Oxi tính năng với diêm sinh (S)
Thực hiện nay thí nghiệm chuyển muỗng sắt gồm chứa một lượng nhỏ dại bột sulfur vào ngọn lửa đèn hễ để quan liêu sát. Tiếp tục đưa lưu giữ huỳnh sẽ cháy vào lọ bao gồm chứa khí oxi và so sánh hiện tượng sulfur cháy vào oxi cùng trong ko khí.
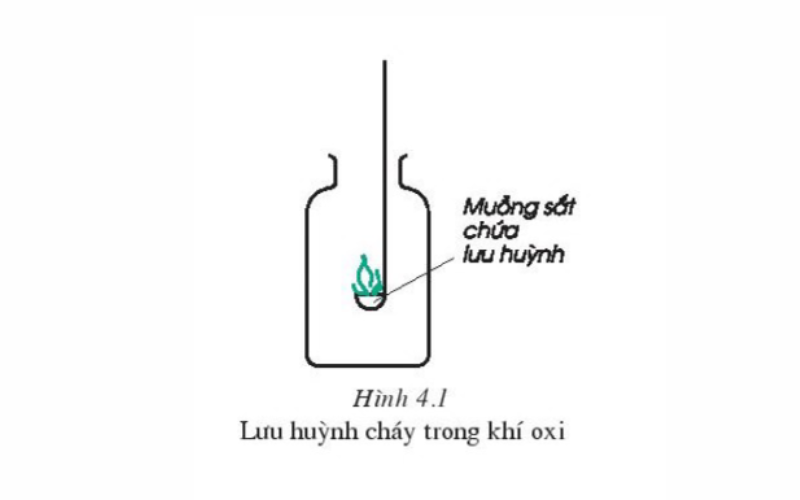
Quan gần kề thí nghiệm ta có thể rút ra thừa nhận xét:
Lưu huỳnh cháy trong không gian với ngọn lửa nhỏ tuổi màu xanh nhạt, khi cháy trong bầu không khí mãnh liệt hơn chế tạo ra thành khí sulfur đioxit SO2 (hay khí sunfurơ) và khôn xiết ít lưu huỳnh trioxit (SO3).
Sự cháy của lưu huỳnh ở trong không khí với khí oxi được biểu diễn bằng phương trình chất hóa học như sau:
S (r)+ O2 (k) → SO2 (k) (Điều kiện: nhiệt độ độ)
Oxi tính năng với photpho (P)
Thực hiện thí nghiệm bỏ vào muỗng sắt một lượng photpho đỏ (chất rắn có màu đỏ nâu, ko tan trong nước). Đưa muỗng sắt gồm chứa photpho vào lọ đựng khí oxi. Quan liền kề xem có dấu hiệu của phản nghịch ứng chất hóa học không. Đốt cháy photpho đỏ trong không gian rồi đưa cấp tốc vào lọ đựng khí oxi và đối chiếu sự cháy của photpho trong ko khí với trong khí oxi. Nhấn xét chất tạo thành làm việc trong lọ với thành lọ.
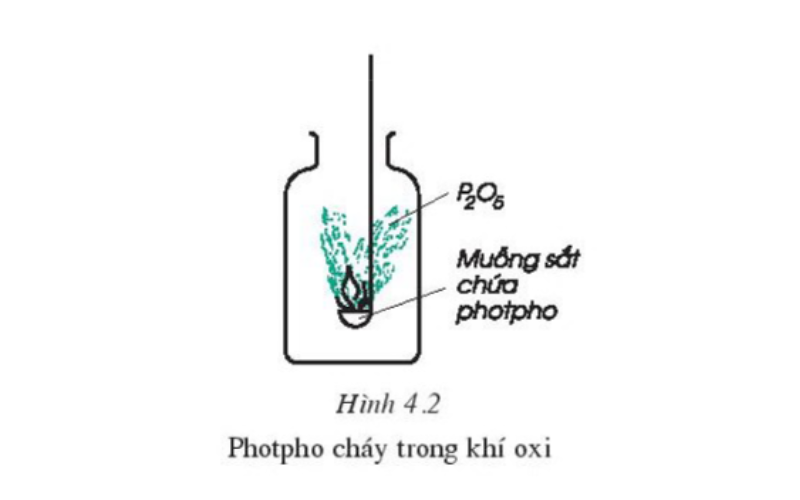
Qua quá trình quan liền kề ta rất có thể dễ dàng rút ra dìm xét: Photpho cháy bạo dạn trong khí oxi cùng với ngọn lửa sáng chói, tạo ra khói trắng xum xê bám vào thành lọ dưới dạng bột tan được trong nước. Bột trắng sẽ là điphotpho pentaoxit, bao gồm công thức hóa học là P2O5.
Ta có phương trình hóa học như sau:
4P (r) + 5O2 (k) → 2P2O5 (r) (Điều kiện: nhiệt độ)
Cacbon cháy trong không khí
C + O2 → CO2 (Điều kiện: nhiệt độ)
Oxi chức năng với thích hợp chất
Ngoài tác dụng với sắt kẽm kim loại và phi kim thì tính năng với hợp chất cũng là giữa những tính chất hóa học quan trọng của oxi.
Oxi tính năng tác khí metan (CH4)
Khí metan (có trong khí bùn ao, khí bioga) cháy trong không khí do tác dụng với khí oxi lan ra những nhiệt. Ta có PTHH:
CH4 (k) + 2O2 (k) → CO2 (k) + 2H2O (h) (Điều kiện: nhiệt độ độ)
Oxi chức năng với teo (CO cháy trong không khí)
2CO + O2 → 2CO2
Etanol cháy trong không khí
C2H5OH + 3O2 → 2CO2 + 3H2O
Điều chế oxi như thế nào?
Có nhiều phương pháp để điều chế oxi, tùy vào mục đích của nó. Dưới đó là những cách điều chế, thêm vào oxi trong phòng thí nghiệm cùng trong công nghiệp phổ biến nhất!

Điều chế oxi trong chống thí nghiệm
Trong phòng thí nghiệm, khí oxi được điều chế bằng cách phân hủy đông đảo hợp chất giàu oxi và ít bền so với nhiệt như KMn
O4 (rắn), KCl
O3 (rắn)… Ví dụ:
2KMn
O4 → K2Mn
O4 + Mn
O2 + O2 (Điều kiện: nhiệt độ độ)
Sản xuất oxi vào công nghiệp
Có 2 phương pháp để sản xuất oxi vào công nghiệp đó là chế tạo từ không khí cùng từ nước.
Sản xuất oxi từ ko khí: Không khí sau thời điểm đã loại trừ hết nước, bụi, khí cacbon đioxit, được hóa lỏng. Chưng cất phân đoạn bầu không khí lỏng vẫn thu được oxi. Oxi được vận chuyển trong số những bình thép bao gồm dung tích 100 lít dưới áp suất 150 atm.
Sản xuất oxi từ bỏ nước: Tiến hành điện phân nước (nước gồm hòa chảy một lượng nhỏ H2SO4 hoặc Na
OH nhằm tăng tính dẫn năng lượng điện của nước), bọn họ thu được khí oxi ở rất dương và khí hidro ở cực âm. PTHH như sau:
2H2O → (điện phân) 2H2 + O2 (k)
Ứng dụng của oxi vào đời sống
Khí oxi tất cả vai trò quan trọng đặc biệt trong đời sống nhỏ người cũng như trong công nghiệp đốt nhiên liệu.

Vai trò của oxi với việc sống của con fan và cồn vật
Oxi có không ít ứng dụng quan trọng, có vai trò quyết định sự sống của con người và động vật. Từng ngày, bọn họ cần khoảng 20-30m3 khí oxi để gia hạn sự sống.
Những thợ trị cháy, phi công tốt thợ lặn khi thực hiện nhiệm vụ đều phải thở khí oxi chứa trong các bình quánh biệt.
Ứng dụng oxi vào công nghiệp – đốt nhiên liệu
Khi những nhiên liệu cháy vào oxi sẽ tạo nên nhiệt độ dài hơn không ít so cùng với cháy trong không khí. Ứng dụng dụng trong công nghiệp đốt xăng của oxi còn mô tả qua hoạt động sản xuất mìn phá đá, oxi lỏng dùng làm đốt xăng trong tên lửa. Một vận dụng khá thân cận của oxi trong công nghiệp luyện gang thép là thổi khí oxi để tạo ánh sáng lớn hơn, nâng cấp hiệu suất và quality của gang cùng thép.
Bài tập về oxi SGK hóa học kèm lời giải chi tiết
Sau khi đã nắm vững những con kiến thức triết lý cơ bạn dạng về oxi bạn hãy bắt tay thực hành làm bài bác tập nhằm hiểu bài bác nhanh rộng nhé. Dưới đấy là một vài ba bài tập về oxi SGK hóa học 8 với 10 Monkey tổng hòa hợp kèm lời giải chi tiết để chúng ta tham khảo.

Bài tập về oxi SGK chất hóa học 8
Bài 1 (SGK hóa học 8, trang 84)
Dùng từ tương thích trong khung nhằm điền vào vị trí trống trong những câu sau:
Kim loại, phi kim, khôn cùng hoạt động, phi kim rất hoạt động, vừa lòng chất.
Khí oxi là một đơn chất … Oxi rất có thể phản ứng với tương đối nhiều …, …, …
Gợi ý đáp án:
Khí oxi là 1 trong đơn chất phi kim rất hoạt động. Oxi hoàn toàn có thể phản ứng với tương đối nhiều phi kim, kim loại, hòa hợp chất.
Bài 2 (SGK chất hóa học 8, trang 84)
Nêu các thí dụ chứng tỏ rằng oxi là 1 đơn hóa học rất hoạt động (đặc biệt ở ánh nắng mặt trời cao)
Gợi ý đáp án:
Oxi là 1 đơn hóa học rất hoạt động (đặc biệt ở ánh sáng cao), ví dụ:
3Fe + 2O2 → Fe3O4.
S + O2 → SO2.
Bài 3 (SGK hóa học 8, trang 84)
Butan bao gồm công thức C4H10 khi cháy tạo thành khí cacbonic và hơi nước, đôi khi tỏa nhiều nhiệt. Viết phương trình hóa học màn biểu diễn sự cháy của butan.
Gợi ý đáp án:
Phương trình hóa học:
2C4H10 + 13O2 → (nhiệt độ) 8CO2 + 10H2O
Bài 4 (SGK chất hóa học 8, trang 84)
Đốt cháy 12,4g photpho trong bình đựng 17g khí oxi tạo ra thành điphotpho pentaoxit P2O5 (là hóa học rắn, trắng).
a) Photpho xuất xắc oxi chất nào còn thừa cùng số mol chất còn quá là bao nhiêu?
b) chất nào được chế tạo thành? khối lượng là bao nhiêu?
Gợi ý đáp án:
a) Ta gồm n
P = 12.4/31 = 0.4 (mol); n
CO2 = 17/32 = 0.53 (mol).
4P + 5O2 → 2P2O5
Xét tỉ lệ thành phần số mol đề bài xích với số mol phương trình của p và O2 ta có:
0.4/4 p. Phản ứng hết với O2 phản ứng dư.
n
O2 pư = 5/4 x n
P = 0.5 (mol).
Xác định n
O2 dư = 0.53 – 0.5 = 0.03 (mol).
b) hóa học tạo thành là điphotpho pentaoxit P2O5.
Ta có n
P2O5 = ½ x n
P = 0.4/2 = 0.2 mol
m
P2O5 = n.M = 0.2 x (31x 2 + 16 x 5) = 28.4 (g).
Bài tập về oxi SGK hóa học 10
Bài tập 1 (SGK Hóa 10, trang 127)
Hãy ghép thông số kỹ thuật electron với nguyên tử say đắm hợp.
Cấu hình electron: A. 1s22s22p5; B. 1s22s22p4; C. 1s22s22p63s23p4; D. 1s22s22p63s23p5
Nguyên tử: a/ Cl; b/ S; c/ O; d/ F
Gợi ý đáp án:
A - d; B - c; C - b; D - a.
Bài 2 (SGK Hóa 10, trang 127)
Chất như thế nào có links cộng hóa trị không cực:
A. H2S; B. O2; C. Al2S3; D. SO2.
Gợi ý đáp án:
B. O2
Bài 4 (SGK Hóa 10, trang 127)
Hãy trình diễn các phương thức điều chế khí oxi trong phòng thí nghiệm cùng trong công nghiệp. Tại sao không áp dụng phương thức điều chế khí oxi trong phòng thí nghiệm đến công nghiệp và ngược lại?
Gợi ý đáp án:
Điều chế oxi trong phòng thí nghiệm:
Trong phòng thí nghiệm, oxi được điều chế bằng phương pháp phân hủy phần nhiều hợp hóa học giàu Oxi với ít mặt với sức nóng như KMn
O4, KCl
O3, ...
2KMn
O4 → K2Mn
O4 + Mn
O2 + O2
2KCl
O3 → 2KCl + 3O2
Điều chế oxi vào công nghiệp:
Có 2 biện pháp sản xuất là:
Sản xuất oxi từ không khí: Không khí sau thời điểm đã vứt bỏ hết nước, bụi, khí cacbon đioxit, được hóa lỏng. Chưng đựng phân đoạn bầu không khí lỏng đang thu được oxi. Oxi được vận chuyển trong số những bình thép bao gồm dung tích 100 lít bên dưới áp suất 150 atm.
Sản xuất oxi từ bỏ nước: Tiến hành năng lượng điện phân nước (nước bao gồm hòa rã một lượng bé dại H2So2 hoặc Na
OH nhằm tăng tính dẫn điện của nước), họ thu được khí oxi ở rất dương cùng khí hidro ở cực âm. PTHH như sau:
2H2O → (điện phân) 2H2 + O2 (k)
Không thể vận dụng tráo đổi 2 quy trình vì pha chế trong công nghiệp nên lượng lớn oxi với ngân sách rẻ trong khi ở phòng thí nghiệm chỉ cần 1 lượng nhỏ.
Trên đây là tổng thể những tin tức về oxi hy vọng sẽ giúp bạn thuận lợi tổng hợp kiến thức và kỹ năng để ôn tập hiệu quả. Tiếp tục thể loại Kiến thức cơ bản của Monkey hằng ngày để đón bài viết liên quan nhiều bài share thú vị nhé! chia sẻ nếu chúng ta thấy bài viết hữu ích hoặc thừa nhận “NHẬN CẬP NHẬT” bên trên đầu nội dung bài viết để đọc các thông tin share sớm duy nhất mỗi tuần từ bỏ Monkey qua email.
Chất được tạo nên từ các nguyên tố, đối chọi chất được khiến cho từ một yếu tắc còn hợp chất được tạo nên từ nhì hay những nguyên tố. Như vậy, từ ký hiệu của nguyên tố ta có thể viết thành công xuất sắc thức hóa học để trình diễn chất.
Vậy giải pháp viết bí quyết hóa học tập của đối chọi chất cùng hợp chất như thế nào?
Công thức hóa học có ý nghĩa gì? họ cùng tìm hiểu qua nội dung bài viết dưới đây.
I. Giải pháp viết Công thức hoá học của đối kháng chất
- cách làm hóa học của đơn chất chỉ bao gồm ký hiệu chất hóa học của một nguyên tố.
1. Đơn hóa học kim loại
- Hạt phù hợp thành là nguyên tử, ký kết hiệu hoá học tập được xem là công thức hoá học.
* Ví dụ: phương pháp lập cách làm hóa học của những đơn hóa học đồng, kẽm cùng sắt là: Cu, Zn, Fe.
2. Đơn chất phi kim
- Với một vài phi kim hạt hợp thành là nguyên tử, ký kết hiệu hoá học tập là bí quyết hoá học.
* Ví dụ: cách làm hóa học tập của 1-1 chất tha, lưu lại huỳnh, phốt pho là: C, S, P.
- với tương đối nhiều phi kim hạt hòa hợp thành là phân tử, thường là 2, thêm chỉ số sống chân ký kết hiệu.
* Ví dụ: cách làm hóa học tập của khí Hidro, Ni tơ, cùng Oxi là: H2, N2, O2.
II. Cách viết công thức hóa học tập của hợp chất
- Hợp hóa học tạo tự 2 nguyên tố, cách làm chung: Ax
By
- Hợp chất tạo từ 3 nguyên tố, công thức chung: Ax
By
Cz
- vào đó:
° A, B, C,... Là kí hiệu hóa học của từng nguyên tố
° x, y, z,... Là những số nguyên chỉ số nguyên tử của nguyên tố bao gồm trong một phân tử hợp chất, nếu các chỉ số này bởi 1 thì không ghi.
* Ví dụ: Công thức chất hóa học của phù hợp chất: nước H2O, natri cloru Na
Cl, can xi cacbonat là Ca
CO3 (lưu ý CO3 là đội nguyên tử).
III. Ý nghĩa của phương pháp hóa học
* Công thức hóa học của 1 hóa học cho biết:
- yếu tắc nào tạo thành chất;
- Số nguyên tử của mỗi nguyên tố có trong một phân tử chất;
- Phân tử khối của chất.
* lấy một ví dụ 1: phương pháp hóa học của khí oxi O2 mang đến biết:
- Khí oxi do nguyên tố oxi chế tạo ra ra;
- gồm 2 nguyên tử trong 1 phân tử oxi
- Phân tử khối: 16.2 = 32 (đv
C).
* lấy ví dụ 2: bí quyết hoá học của axit sunfuric H2SO4 cho biết:
- Axit sunfuric vày 3 nguyên tố: H, S, O tạo thành
- Một phân tử axit sunfuric tất cả 2H, 1S, 4O
- Phân tử khối:= 1.2 + 32 + 16.4 = 2 + 32 + 64 = 98 (đv
C).
* Một số lưu ý:
- Viết H2 đểchỉ 1 phân tử hidro, khác với khi viết 2H nhằm chỉ 2 nguyên tử hidro;
- công thức hóa học H2O cho thấy 1 phân tử nước cos2 nguyên tử hidro cùng 1 nguyên tử oxi.(Nói vào phân tử nước gồm phân tử hidro là SAI);
- Để chỉ 3 phân tử hidro viết 3H2, nhị phân tử nước viết 2H2O,... Các số 3 với 2 đứng trước là hệ số, đề nghị viết ngang bằng ký hiệu.

IV. Bài tập về bí quyết hóa học
* Bài 1 trang 33 SGK Hóa 8: Chép vào vở bài bác tập đa số câu dưới đây với không hề thiếu những từ ham mê hợp:
Đơn chất tạo nên từ một ... Cần công thức chất hóa học chỉ có một ... Còn ... Tạo cho từ hai, bố ... Bắt buộc công thức hóa học gồm hai, cha ... Chỉ số ghi sinh hoạt chân kí hiệu hóa học, thông qua số ... Có trong một ...;
* Bài 2 trang 33 SGK Hóa 8: Cho công thức hóa học của các chất sau:
a) Khí clo Cl2.
b) Khí metan CH4.
c) Kẽm clorua Zn
Cl2.
d) Axit sunfuric H2SO4.
Hãy nêu mọi gì biết được từ mỗi chất
* Bài 3 trang 34 SGK Hóa 8: Viết công thức hóa học với tính phân tử khối của những hợp chất sau:
a) Canxi oxit (vôi sống), biết trong phân tử bao gồm 1Ca với 1O.
b) Amoniac, biết vào phân tử có 1N với 3H.
c) Đồng sunfat, biết trong phân tử bao gồm 1Cu, 1S với 4O
* Bài 4 trang 34 SGK Hóa 8: a) Các giải pháp viết sau chỉ phần lớn ý gì 5Cu, 2Na
Cl, 3Ca
CO3.
b) Dùng chữ số và bí quyết hóa học để diễn đạt những ý sau: bố phân tử oxi, sáu phân tử canxi oxit, năm phân tử đồng sunfat.
Xem thêm: Tuyển Tập Bài Giảng Ngữ Văn 6 Chân Trời Sáng Tạo (Cả Năm), Bài Giảng Ngữ Văn 6 (Chân Trời Sáng Tạo)
Hy vọng bài viết này đã giúp các em biết cách lập công thức hóa học của solo chất, phù hợp chất, phương pháp viết với ý nghĩa của chúng, đồng thời vận dụng vào những bài tập rứa thể. Hay
Hoc
Hoi chúc những em học giỏi và nhớ rằng để lại góp ý hay vướng mắc nếu có ở bên dưới phần dấn xét nhé.