Trong hóa học, axit sunfuric là hóa chất được sử dụng phổ biến hiện thời với những, đặc điểm, đặc thù hóa học và áp dụng đặc biệt. Là 1 trong những hóa chất công nghiệp quan trọng, axit sunfuric được ứng dụng rộng rãi trong để th-nc p
H trong giải pháp xử lý nước thải, với được áp dụng trong cấp dưỡng phân bón, chế tao quặng, tổng vừa lòng hóa học, tinh luyện dầu mỏ…
Mua hóa chất Axit Sunfuric H2SO4 95% tại đây
Vậy thì axit sunfuric là gì?
Axit sunfuric là 1 trong axit vô sinh gồm các nguyên tố lưu giữ huỳnh, oxy cùng hydro với phương pháp hóa học tập là H2SO4. Axit sunfuric là hóa chất lỏng ko màu, ko mùi với sánh, hòa tan trong nước và một làm phản ứng tỏa nhiệt cao.
Bạn đang xem: Công thức hóa học của axit sunfuric
1. đặc thù vật lý của axit sunfuric
– Axit sunfuric là chất lỏng, tương đối nhớt cùng nặng hơn nước, khó cất cánh hơi với tan vô hạn vào nước
– Axit sunfuric sệt thường hút bạo gan nước và tỏa những nhiệt nên những lúc pha loãng đề nghị cho thong dong axit quánh vào nước mà lại không làm ngược lại, vị H2SO4 hoàn toàn có thể gây bỏng.
– Axit sunfuric còn có khả năng làm than hóa các hợp chất hữu cơ.
2. đặc điểm hóa học tập của axit sunfuric
a, Axit sunfuric loãngAxit sunfuric là 1 trong axit mạnh, chất hóa học này có tương đối đầy đủ các đặc thù hóa học chung của axit như:
– Axit sunfuric H2SO4 làm chuyển màu quỳ tím thành đỏ.
– tác dụng với kim loại đứng trước H (trừ Pb) tạo ra thành muối bột sunfat:
Fe + H2SO4 → Fe
SO4 + H2
– tính năng với oxit bazo sinh sản thành muối new (trong đó kim loại không thay đổi hóa trị) cùng nước
Fe
O + H2SO4 → Fe
SO4 + H2O
– Axit sunfuric chức năng với bazo chế tác thành muối new và nước
H2SO4 + Na
OH → Na
HSO4 + H2O
H2SO4 + 2Na
OH → Na2SO4 + 2H2O
– H2SO4 tính năng với muối sản xuất thành muối bắt đầu (trong đó kim loại vẫn giữ nguyên hóa trị) với axit mới
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
b, Axit sunfuric đặc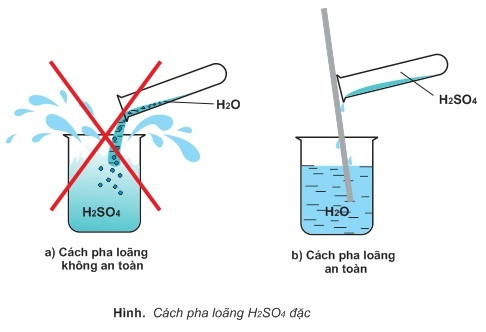
Axit sunfuric đặc gồm tính axit mạnh, oxi hóa to gan với đặc điểm hóa học khá nổi bật như:
– tác dụng với kim loại: Khi mang đến mảnh Cu vào trong H2SO4 tạo nên dung dịch có màu xanh da trời và tất cả khí cất cánh ra với mùi sốc.
Cu + 2H2SO4 → Cu
SO4 + SO2 + 2H2O
– công dụng với phi kim tạo thành thành oxit phi kim + H2O + SO2
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ)
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
– chức năng với các chất khử khác
2Fe
O + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
– H2SO4 còn tồn tại tính háo nước đặc thù như gửi H2SO4 vào cốc đựng đường, sau bội phản ứng đường có khả năng sẽ bị chuyển thanh lịch màu black và xịt trào với phương trình hóa học như sau:
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
3. Điều chế axit sunfuric
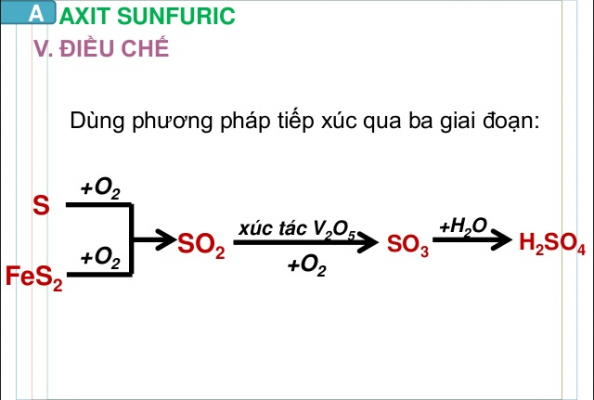
Thông thường H2SO4 được sản xuất bằng phương pháp đốt cháy quặng firit sắt, lão hóa SO2 bởi oxi trong điều kiện 400 – 500 độ C, pha loãng hóa chất oleum thành axit sunfuric bằng lượng nước say mê hợp…
4. Những dạng của axit sunfuric
– mang dù hoàn toàn có thể sản xuất axit sunfuric 100%, cơ mà nó vẫn mất SO3 sống điểm sôi để tạo ra axit 98,3%. Những nồng độ khác nhau của axit sunfuric được áp dụng với những mục đích khác nhau hoàn toàn có thể kể mang lại như:
– Axit sunfuric loãng cần sử dụng trong phòng thí nghiệm thường chỉ có 10%
– dùng cho ắc quy khoảng 33,5%
– các chất 62,18% là axit được dùng để sản xuất phân bón
– 77,67% được dùng trong tháp tiếp tế hay axit glover
– 98% là axit đậm đặc
5. Tính dẫn điện và tính phân rất của H2SO4
Axit sunfuric khan là 1 trong chất lỏng phân cực, hằng số điện môi khoảng 100. Điều này là vì nó hoàn toàn có thể phân ly bằng cách tự proton hóa bao gồm nó, là một quá trình được biết đến là từ bỏ proton hóa.
Phương trình thể hiện:
2 H2SO4 → H3SO4+ + HSO4−Ứng dụng của hóa chất sunfuric vào đời sống
Axit sunfuric là chất hóa học hàng đầu, được dùng nhiều trong công nghiệp tiếp tế với sứ mệnh là nguyên vật liệu chính hoặc hóa học xúc tác. Hóa chất H2SO4 được sử dụng không ít trong phân phối phân bón, chất giặt tẩy cọ tổng hợp, cung ứng tơ tua hóa học, hóa học dẻo, sơn màu.
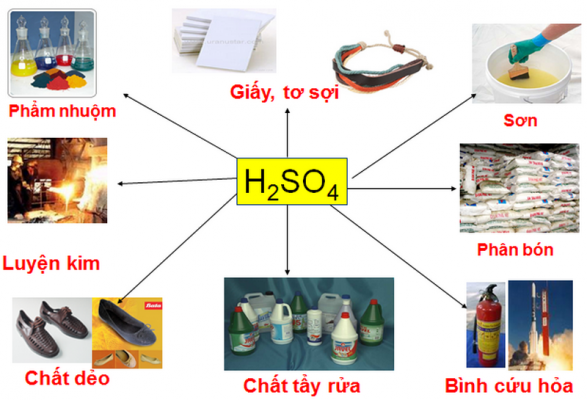
1. Trong cung cấp phân bón
Axit sunfuric đa phần được sử dụng trong tiếp tế axit photphoric, là hóa học được áp dụng để sản xuất những loại phân photphat, cùng cũng dùng làm sản xuất Amoni sunfat.
2. Trong cấp dưỡng công nghiệp
Axit sunfuric được sử dụng rộng thoải mái trong quy trình sản xuất sắt kẽm kim loại như thêm vào đồng, kẽm và sử dụng trong có tác dụng sạch mặt phẳng thép với dung dịch tẩy gỉ.
Ngoài ra, axit sunfuric còn được thực hiện để sản xuất nhôm sunfat (ví dụ như phèn có tác dụng giấy). Sản xuất những loại muối bột sunfat, tẩy cọ kim loại trước lúc mạ, chế tạo thuốc nổ, hóa học dẻo, thuốc nhuộm, cung ứng dược phẩm.
Hỗn hợp axit cùng với nước được dùng để gia công chất điện giải trong mặt hàng loạt những dạng ắc quy, axit chì…
Mỗi năm có tầm khoảng 160 triệu tấn H2SO4, vào đó nổi bật khi được sử dụng trong những ngành sản xuất như phân bón 30%, luyện kim 2%, phẩm nhuộm 2%, chất dẻo 5%, hóa học tẩy cọ 14%, giấy, sợi 8%…
3. Trong xử lý nước thải
Sản xuất nhôm hidroxit là chất được sử dụng trong các nhà máy giải pháp xử lý nước để lọc những tạp chất, cũng như cải thiện mùi vị của nước, trung hòa p
H vào nước, và sử dụng để loại trừ các ion Mg2+, Ca2+ có trong nước thải
Lưu ý: Về hiểm họa của axit sunfuric, đấy là hóa hóa học nguy hiểm, hạng một bào mòn và gây bỏng rộp da. Chính vì như vậy khi thực hiện nên trang bị rất đầy đủ các lao lý chuyên dụng, mặt nạ phòng độc cá nhân, khẩu trang, tủ hút khio pha chế…
Axit Sunfuric là hợp hóa chất vô cùng phổ cập và được ứng dụng thoáng rộng trong đời sống xã hội. H2SO4 là gì? đặc thù vật lý với hóa học tập của một số loại Axit này là gì? Hãy cùng mày mò về H2SO4 ngay dưới đây nhé.
H2SO4 là gì?
H2SO4 (Axit Sunfuric) được mệnh danh là ông vua trong hóa học. Giữ vai trò vô cùng quan trọng đặc biệt trong việc cách tân và phát triển các ngành công nghiệp hiện nay.
H2SO4 là axit vô cơ thông dụng nhất hiện tại nay. Nó được chế tạo thành trường đoản cú nguyên tố diêm sinh (S), oxy (O) cùng hydro (H). Công thức hóa học của loại Axit này là H2SO4. Tên trong giờ Anh của H2SO4 là Acid Sulfuric. Loại Axit này còn được biết đến dưới tên gọi dầu Sulfate và Hydro sulfate.
Xem lại bảng tuần hoàn các nguyên tố hóa học
Tính hóa học vật lý của H2SO4
Tính hóa học vật lý của H2SO4 sệt hay loãng cũng đầy đủ như nhau, là dạng chất lỏng hơi nhớt không màu không mùi không vị. H2SO4 khó cất cánh hơi, nó nặng rộng nước với tan vô hạn trong nước.
Axit Sunfuric sệt háo nước và khi hút nước đã tỏa các nhiệt. Khi thực hành thí nghiệm, chỉ nên cho thủng thẳng H2SO4 sệt vào nước. Hoàn hảo và tuyệt vời nhất không làm trái lại vì Axit sẽ bắn lên gây bỏng.
H2SO4 rất có thể than hóa các hợp hóa học hữu cơ.
Tính hóa chất của H2SO4
H2SO4 gồm tính axit cực kỳ mạnh, tính làm mòn của nhiều loại Axit này cũng tương đối đáng kể. Axit Sunfuric có thể gây nguy hiểm cho ngẫu nhiên thứ gì chạm vào nó nếu đầy đủ nồng độ độc nhất vô nhị định.
Axit Sunfuric gồm độ trở nên động tương đối thấp cần giữ vai trò quan trọng trong câu hỏi điều chế những loại Acid dễ bay hơi. Vày đặc tính háo nước của mình, H2SO4 còn được sử dụng để làm khô nhiều các loại khí không phản ứng với axit.
Tính Axit của H2SO4 rất có thể làm quỳ tím hóa đỏ.
Axit Sunfuric tồn tại dưới hai loại: axit đặc với axit loãng.

Tính chất hóa học của H2SO4 đặc
Trong H2SO4, nguyên tố giữ huỳnh bao gồm mức oxi hóa +6 là cao nhất của yếu tắc này. Dẫn đến, H2SO4 đặc có tính axit mạnh, tính oxi hóa với háo nước mạnh.
Do tính Axit mạnh của mình nên H2SO4 tác dụng được với hầu như tất cả kim loại ( trừ Au cùng Pt). Axit Sunfuric đặc, nóng tính năng với sắt kẽm kim loại tạo thành muối sắt kẽm kim loại có hóa trị cao, nước cùng SO2 ( H2S, S ).
2Al +H2SO4 đặc nóng → Al2(SO4)3 + 3SO2 + 6H2O
Cu + H2SO4đặc nóng → Cu
SO4 + SO2 + 2H2O
2Fe +H2SO4đặc nóng → Fe2(SO4)3 + 3SO2 + 6H2O
3Cr + 4H2SO4đặc rét → 3Cr
SO4 + 4H2O + S
H2SO4 đặc nguội có khả năng sẽ bị thụ đụng hoá cùng với nhôm ( Al), fe ( Fe) cùng Crom (Cr) phải không thể hình thành phản ứng.
Axit Sunfuric đặc tác dụng với phi kim sản xuất thành oxit phi kim, nước và khí SO2
S +2H2SO4đặc nóng → 3SO2 + 2H2O
Axit Sunfuric đặc nóng tính năng với những chất khử khác chế tạo thành muối, nước cùng khí SO2
H2SO4đặc lạnh + 8HI → H2S + 4I2 + 4H2O
H2SO4 đặc gồm tính háo nước
Thí nghiệm: mang lại H2SO4 sệt vào lọ đựng đường. Quan lại sát hiện tượng lạ ta thấy đường chuyển sang màu đen và sôi trào.
Phương trình biểu đạt phản ứng này như sau:
C12H22O11 + H2SO4 → 12C + H2SO4 .11H2O
Tính hóa chất của H2SO4 loãng
Axit Sunfuric ngơi nghỉ dạng loãng là 1 Axit mạnh, có không thiếu thốn tính chất của một Axit thường chạm chán như:
– H2SO4 có tác dụng quỳ tím hóa đỏ.
– chức năng với Kim loại, Bazo, Oxit Bazo và muối để tạo nên các chất nên thiết.
– Axit Sunfuric chức năng với kim loại đứng trước H trừ PB sinh sản thành muối hạt Sunfat:
Fe + H2SO4 → Fe
SO4 + H2 bay hơi.
– Axit Sunfuric tác dụng với Oxit Bazo tạo thành muối bắt đầu và nước:
Fe
O + H2SO4 → Fe
SO4 + H2O
– Axit Sunfuric kết phù hợp với Bazo tạo nên thành muối new + nước:
H2SO4 + Na
OH → Na
HSO4 + H2O
H2SO4 + 2Na
OH → Na2SO4 + 2H2O
– Axit Sunfuric công dụng với Muối tạo thành Axit bắt đầu và muối mới:
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2↑
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2↑
HCO3 là một trong những Axit yếu, nên những lúc được có mặt đã nhanh lẹ trở thành H2O và CO2.
Các dạng của axit sunfuric (H2SO4)
Tùy theo mục đích sử dụng nhưng H2SO4 vĩnh cửu ở nhiều dạng khác nhau:
H2SO4 loãng được thực hiện trong phòng thí nghiệm chỉ là 10%.Axit Sunfuric được sử dụng cho bình ắc quy bao gồm nồng độ ở khoảng 33,5%.Hàm lượng 62,18% thường xuyên được dùng làm sản xuất phân bón.Trong tháp phân phối hay axit glover, hàm vị H2SO4 được thực hiện là 77,67%.Axit Sunfuric đậm đặc có nồng độ là 98%.Tham khảo bảng đơn vị đo khối lượng
Cách pha chế H2SO4
Đốt cháy quặng Pirit sắt là một trong những cách pha trộn H2SO4 phổ biến; oxi hóa SO2 thông qua oxi ở nhiệt độ từ 400 – 500 độ C; Hoặc pha loãng chất oleum với lượng nước vừa đủ để tạo thành H2SO4.
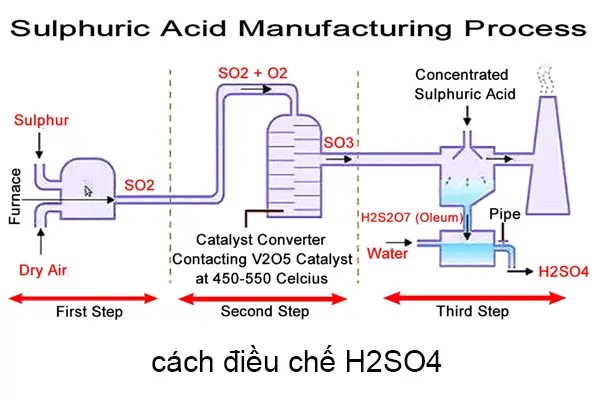
Đốt cháy quặng pirit sắt
Fe
S2 + O2 → SO2 + Fe2O3
Oxi hóa SO2 thông qua oxi trong đk nhiệt độ 400 – 5000C, và cần chất xúc tác V2O
SO2 + O2 → SO3
Axit sunfuric H2SO4 sệt hấp thụ SO3 tạo thành oleum
n
SO3 + H2SO4 → H2SO4.n
SO3
Pha loãng oleum cùng với nước
H2SO4 .n
SO3 + (n+1) H2O→ (n+1)H2SO4
Tham khảo thêm nhiều tài liệu chất hóa học khác trên giaoducq1.edu.vn
Ứng dụng của H2SO4
Axit sunfuric là được dùng thông dụng trong những ngành công nghiệp với phương châm là nguyên vật liệu chính hoặc hóa học xúc tác những phản ứng hóa học. H2SO4 được sử dụng rất nhiều trong quá trình sản xuất phân bón, chất tẩy cọ tổng hợp, tơ sợi hóa học, chất dẻo cùng sơn màu.
Điều chế axit nitric, axit clohidric trong phòng thí nghiệm
Axit Sunfuric được dùng làm điều chế các axit yếu hơn như là HCl, HNO3. Đáp ứng các nhu cầu về chất hóa học trong chống thí nghiệm.
H2SO4 vào công nghiệp
Ước tính hàng năm có khoảng 160 triệu tấn Axit Sunfuric được sử dụng. H2SO4 được sử dụng nhiều và khá nổi bật trong các ngành sản xuất luyện kim, phẩm nhuộm, hóa học dẻo, chất dùng để tẩy rửa, giấy cùng sợi…
H2SO4 là axit táo bạo nên được sử dụng thịnh hành trong quy trình sản xuất đồng, kẽm,…Làm sạch bề mặt thép hoặc những dung dịch tẩy gỉ.
Sản xuất nhôm sunfat trường đoản cú H2SO4 là phương pháp tối ưu. Axit Sunfuric còn được dùng để sản xuất những loại muối sunfat, tẩy rửa kim loại trước khi thực hiện mạ, chế tạo thuốc nổ,…
Hỗn phù hợp H2SO4 với nước được dùng thoáng rộng trong ac-quy với sứ mệnh là chất điện giải.
H2SO4 trong xử trí nước thải
Axit Sunfuric được dùng để làm sản xuất nhôm hidroxit. Sau đó, nhôm hidroxit là được thực hiện để lọc các tạp chất, cũng như nâng cao mùi vị của nước, giúp th-nc p
H vào nước, và thực hiện để sa thải các ion sắt kẽm kim loại như Mg2+, Ca2+ gồm trong nước thải. Ngoại trừ ra, H2SO4 còn nhiều ứng dụng rộng rãi, bao quát nhiều cẩn thận trong đời sống.
Xem thêm: Công Thức Hóa Học Của Oxi Và Khí Hiđro Lần Lượt Là? Tính Chất Hóa Học Của Oxi Hóa 8
Qua bài viết, họ đã cùng khám phá H2SO4 là gì, tính chất, biện pháp chế tạo, tác dụng của hợp hóa học này. giaoducq1.edu.vn ao ước gửi đến độc giả những kỹ năng hữu ích độc nhất về hợp chất hóa học này nhé.