III. Các công thức hoá học lớp 11: phản bội ứng nắm Halogen V. Các công thức hoá học tập lớp 11: làm phản ứng cộng1. Cộng H2:
Lý thuyết hoá hữu cơ không hề ít vì vậy phần bài bác tập cũng tương đối đa dạng. Để các em làm giỏi các dạng bài bác tập phần hóa hữu cơ, loài kiến Guru cung ứng cho những em Các bí quyết hoá học lớp 11 để góp giải nhanh câu hỏi hiđrocabon.

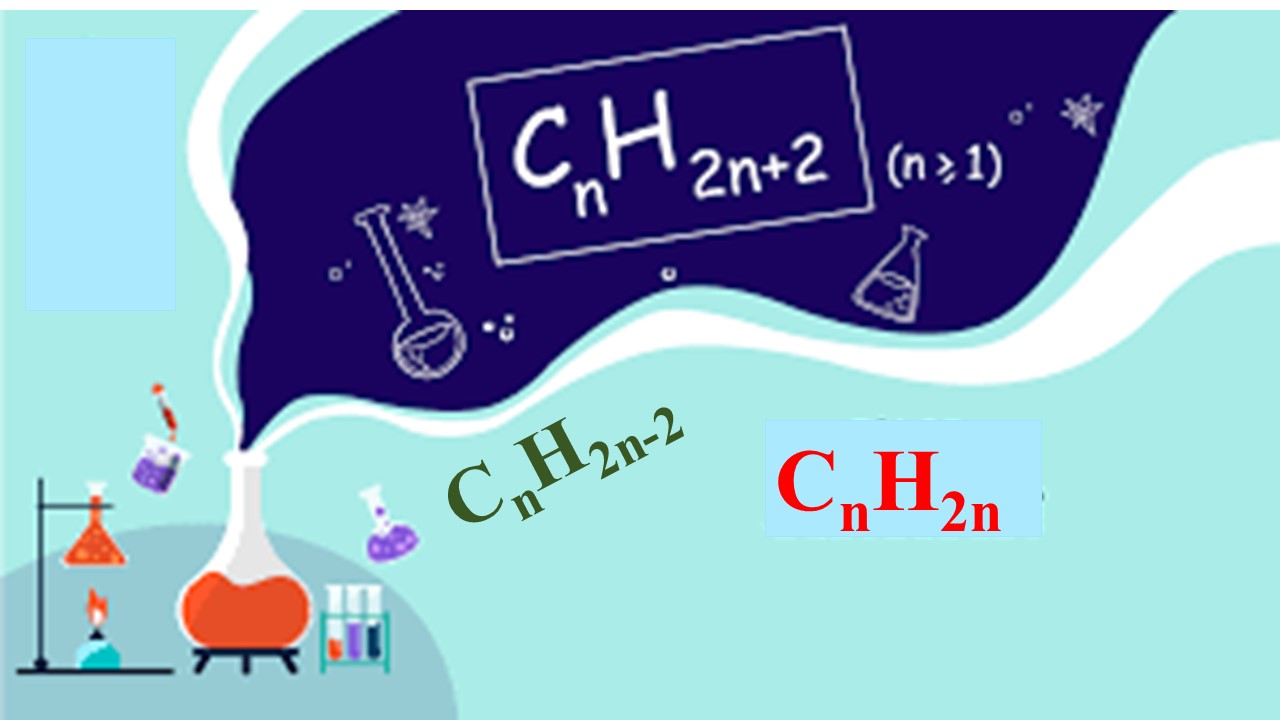

Các phương pháp hoá học lớp 11
Nếu nắm rõ được những phản ứng cùng Các phương pháp hoá học tập lớp 11 trên đây, những em vẫn giải được các dạng bài tập về hiđrocacbon. Hãy rèn luyện và áp dụng thật nhiều các em nhé!
Tổng hợp các công thức chất hóa học vô cơ lớp 11Điện lyHằng số axit, hằng số bazơp
H của dung dịch, chất chỉ thị màu
Phản ứng thương lượng ion vào dung dịch chất điện li Nitơ- Photpho Photpho Cacbon – Silic
Công thức chất hóa học hữu cơ lớp 11Chủ đề lập cách làm phân tử hợp hóa học hữu cơ
Lập công thức phân tử chất hữu cơ
Tổng hợp những công thức hóa học vô cơ lớp 11
Điện ly
Dung dịch



Dựa theo độ điện li ta phân một số loại thành 2 các loại chất điện li



Hằng số axit, hằng số bazơ
Hằng số axit

p
H của dung dịch, chất thông tư màu

H, độ p
H trong các môi trường


H của dung dịch


Đối cùng với axit yếu, bazơ yếu



H đệm của dung dịch



Phản ứng đàm phán ion vào dung dịch chất điện li



Cách biểu diễn phương trình bên dưới dạng phân tử với ion




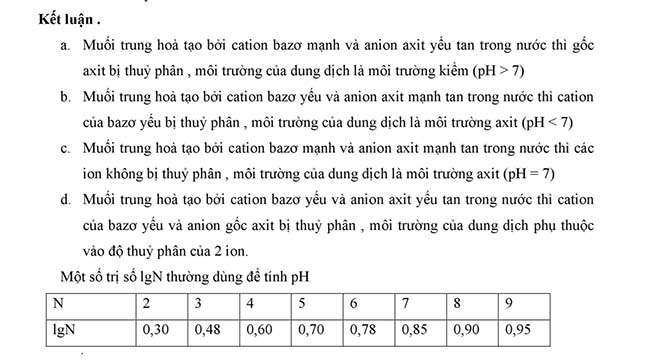
H hỗn hợp khi pha loãng bằng nước


Nitơ- Photpho
Tổng hợp các công thức chất hóa học lớp 11 phần Nitơ và hợp hóa học của Nitơ.
Bạn đang xem: Công thức hóa học 11
– phương pháp điều chế Nitơ
NH4NO2 →t° N2+ 2H2O
NH4Cl + Na
NO2 →t° N2+ Na
Cl + 2H2O
Công thức điều chếNH3
NH4++ OH– → NH3↑+ H2O
Các cách làm hóa học tương quan đến hợp chất của NitơAxit Nitric : HNO3
HNO3 không bền khi có ánh sách vẫn phân hủy 1 phần tạo thành NO2. Ta bao gồm công thức phân diệt sau.
4HNO3→4NO2+ O2+ 2H2O
Bên cạnh đó những em cần quan trọng đặc biệt nhớ đặc điểm của HNO3 khi công dụng với kịm loại. Hợp chất của Nitơ này hoàn toàn có thể oxi hóa phần nhiều các kim loại ngoại trừ Au cùng Pt.
Xem thêm:
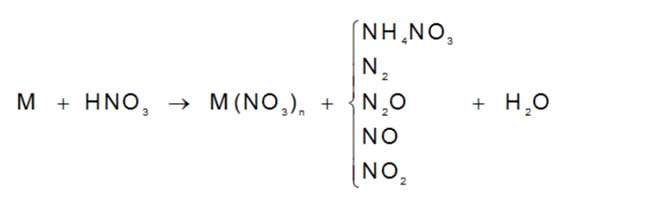
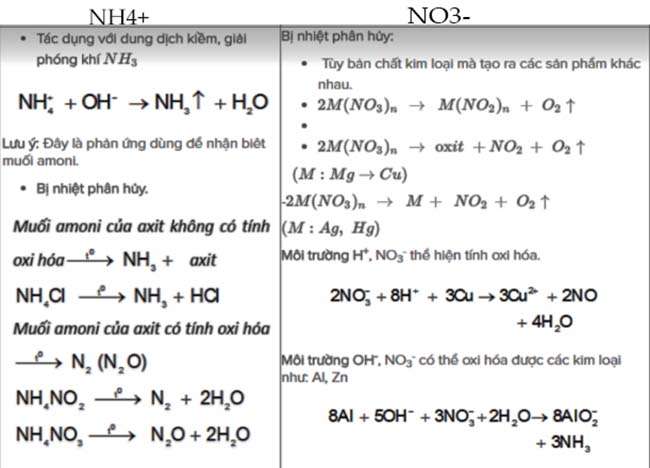
Muối amoni
NH4+ và
NO3–
Một số công thức hóa học quan trọng
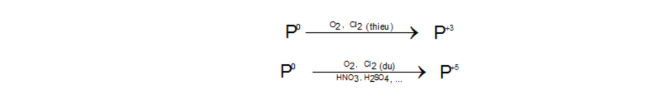
Photpho
Tính oxi hóa: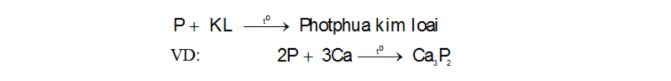
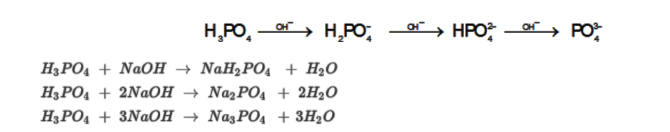
PO43-+ H2O↔ HPO42-+ OH–
H2PO4–+ H2O↔ H3O++ HPO42-
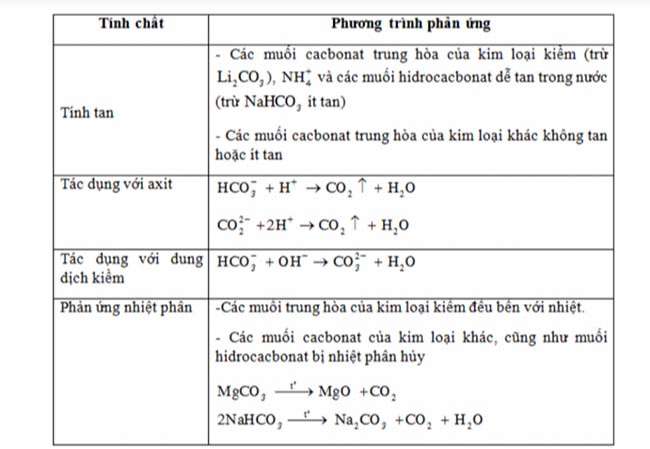
Cacbon – Silic
CacbonTính oxi hóa của Cacbon khi chức năng với:
Hidro:C+ 2H2→(tº, xt) CH4Kim loại:Al + C→ (t°) Al4C3Hợp chất của cabon và những công thức hóa học nên nhớ.Cacbonđioxit (CO2)Phản ứng với dung dịch kiềm:
CO2+ OH–→ HCO3–
CO2+ 2OH–→ CO32-+ H2O
Muối cacbonatCO2 bội nghịch ứng với hỗn hợp kiệm tạo thành 2 muối hạt HCO3– và
CO32-
Công thức hóa học về tính khwr cùng tính oxi hóa của silic
✅ PHƯƠNG PHÁP HỌC TỐT MÔN HÓA
Công thức hóa học hữu cơ lớp 11
Xác định thành phần nguyên tố (m, %)


Chủ đề lập bí quyết phân tử hợp hóa học hữu cơ
Xác định thành phần xác suất khối lượng

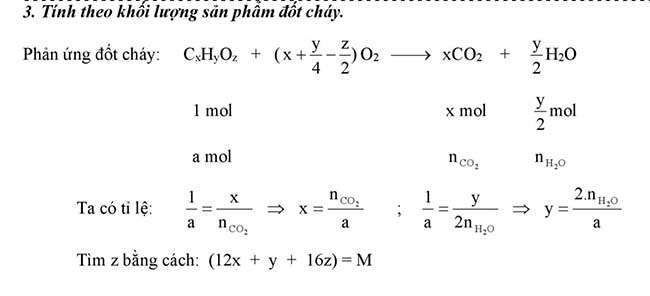
Lập phương pháp phân tử hóa học hữu cơ
Dựa vào phần trăm khối lượng các nguyên tố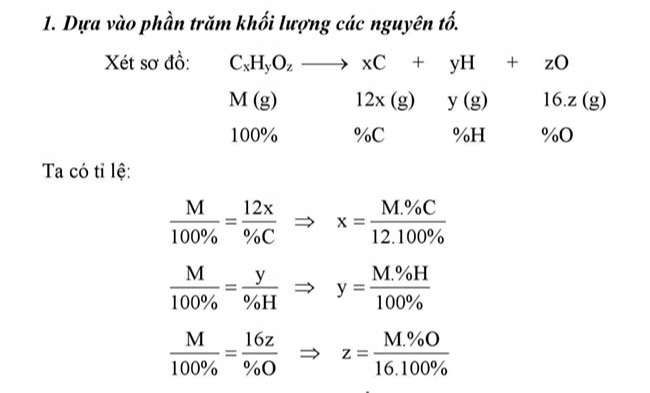


✅ CÔNG THỨC TOÁN 12 ⭐️⭐️⭐️⭐️⭐️