Kiến Guru chia sẻ đến chúng ta học sinh các công thức hóa học tập lớp 10 không thiếu thốn và chi tiết nhất. Bao hàm các công thức cơ bản và đặc trưng nhất ngơi nghỉ từng chương. Ngoài ra kèm theo một trong những bài tập vận dụng. Hi vọng bài viết sẽ giúp các bạn nắm kĩ tổng quan các bí quyết hóa học tập lớp 10.
Bạn đang xem: Công thức hóa học 10



Câu 1: Trong phân tử nhân nguyên tử X có 26 proton. Chọn số phát biểu đúng trong số phát biểu sau về X:
A. X tất cả 26 electron trong hạt nhân. B. X có 26 notron làm việc vỏ nguyên tử. C. X có điện tích hạt nhân là 26+. D. Trọng lượng nguyên tử X là 26u.
Câu 2: Biết rằng nguyên tử crom có cân nặng 52u, bán kính nguyên tử bởi 1,28 Å. Trọng lượng riêng của nguyên tử crom là bao nhiêu?
A. 2,47 g/cm3. B. 9,89 g/cm3. C. 5,92 g/cm3. D. 5,20 g/cm3.
Câu 3: mang đến biết Oxit ứng cùng với hóa trị tối đa của nhân tố R tất cả công thức R2O5. Trong hợp hóa học của nó cùng với hiđro, R chiếm phần 82,35% về khối lượng. R là nguyên tố
A. N B. P C. Na D. Fe
Câu 4: vừa lòng chất cách làm hóa học tập là M2X tạo bởi vì hai nguyên tố M và X. Biết rằng: tổng thể proton trong hợp hóa học M2X bởi 46. Trong hạt nhân M có n – p = 1, hạt nhân của X bao gồm n’ = p’. Trong hợp chất M2X, yếu tố X chiếm phần 8/47 trọng lượng phân tử. Số phân tử proton trong phân tử nhân nguyên tử M, X và liên kết trong hợp chất M2X theo lần lượt là bao nhiêu?
A. 19, 8 và liên kết cộng hóa trị B. 19, 8 và liên kết ion C. 15, 16 và links ion D. 15, 16 và links cộng hóa trị
Câu 5: cho 1 mol mỗi chất: Ca
OCl2, KMn
O4, K2Cr2O7, Mn
O2 lần lượt bội nghịch ứng lượng dư dung dịch HCl đặc, chất nào sẽ tạo nên khí Cl2 nhiều nhất trong những chất bên dưới đây.
A. Ca
OCl2 B. KMn
O4 C. K2Cr2O7 D. Mn
O2
Câu 6: đến 3,16 gam hóa học KMn
O4 chức năng cùng với hỗn hợp HCl quánh (dư), số mol HCl sau phản ứng bị oxi hóa bao nhiêu? lựa chọn đáp án chính xác bên dưới:
A. 0,05 B. 0,11 C. 0,02 D. 0,10
Câu 7: lúc đốt cháy trọn vẹn 7,2 gam kim loại tên gọi M (có hóa trị II không thay đổi trong phù hợp chất) trong khí Cl2 dư, người ta thu 28,5 gam muối. Kim loại M là kim loại nào trong số chất mặt dưới:
A. Be B. Na C. Ca D. Mg
Câu 8: cho 69,6 gam mangan đioxit tính năng cùng với dung dịch axit clohidric đặc. Cục bộ lượng khí clo có mặt được hấp phụ hết vào 500 ml hỗn hợp Na
OH 4M, thu 500 ml dung dịch X. Nồng độ mol Na
Cl và Na
OH dung dịch X là từng nào trong các tác dụng dưới đây?
A. 1,6M với 0,8M B. 1,6M cùng 1,6M C. 3,2M và 1,6M D. 0,8M và 0,8M
Câu 9: Dẫn 4,48 lít hỗn hợp khí N2 với Cl2 vào hỗn hợp Ca(OH)2 dư. Sau làm phản ứng (xảy ra hoàn toàn), sót lại 1,12 lít khí thoát ra. Tính phần trăm thể tích của Cl2 vào hỗn hợp trên (Chọn đáp án đúng chuẩn nhất trong những câu sau)
A. 88,38% B. 75,00% C. 25,00% D. 11,62%
Câu 10: cho hấp thụ trọn vẹn 2,24 lít khí Cl2 (đktc) vào 200 ml dung dịch Na
OH (ở ánh sáng thường). Mật độ Na
OH sót lại sau phản ứng là 0,5M (giả thiết thể tích dung dịch không chũm đổi). Nồng độ mol ban đầu của dung dịch Na
OH là
A. 0,5M B. 0,1M C. 1,5M D. 2,0M
Đáp án:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C | B | B | B | C | D | D | A | B | C |
Trên đây, kiến Guru đã share tới các bạn tóm tắt các công thức hóa học tập lớp 10 đầy đủ nhất, hỗ trợ các bạn trong câu hỏi học tập và ôn luyện trong các kỳ thi.
Để giúp chúng ta nắm vững kiến thức và làm bài tập tốt, thư viện Hỏi Đáp chia sẻ đến bạn những công thức hóa học lớp 10 đầy đủ, cụ thể nhất. Hãy đọc ngay nhé!
Trong nội dung bài viết hôm nay, tủ sách Hỏi Đáp có đến cho chính mình đọc những kỹ năng về các bí quyết hóa học tập lớp 10 đầy đủ, chi tiết nhất. Hy vọng đây sẽ là cuốn sổ tay công thức giúp cho bạn học giỏi môn chất hóa học lớp 10 nhé!
Bạn đang xem bài: Tổng hợp những công thức hóa học lớp 10 đầy đủ, cụ thể nhất
Nội dung câu trả lời
Các phương pháp hóa học lớp 10 đầy đủ, cụ thể nhấtChương 1: Nguyên tử
Chương 2: Bảng tuần hoàn các nguyên tố chất hóa học – Định phương pháp tuần hoàn
Chương 3: liên kết hóa học
Chương 4: bội nghịch ứng oxi hóa – khử
Chương 5: nhóm halogen
Chương 6: Oxi – lưu giữ huỳnh
Chương 7: tốc độ phản ứng – cân đối hóa học
Bài tập vận dụng những công thức hóa học lớp 10
Nội dung chủ yếu trong bài
Các phương pháp hóa học lớp 10 đầy đủ, cụ thể nhất
Bài tập vận dụng các công thức hóa học lớp 10
Các bí quyết hóa học tập lớp 10 đầy đủ, cụ thể nhất
Nội dung chương trình Hóa học lớp 10 có không ít kiến thức với công thức đề xuất nhớ khiến cho bạn phải đau đầu. Vì thế, thư viện Hỏi Đáp để giúp đỡ bạn tổng hợp các công thức hóa học lớp 10 vào từng chương một phương pháp đầy đủ, chi tiết nhất.
Chương 1: Nguyên tử
Công thức thứ nhất trong nội dung những công thức hóa học lớp 10 kia là bí quyết tính nguyên tử. Thành phần cấu trúc nguyên tử gồm hạt nhân (số Proton + số Nơtron ) cùng vỏ nguyên tử (Electron).
Ký hiệu nguyên tử
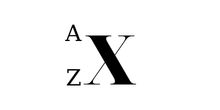
Trong đó:
X là kí hiệu hóa học.A là số khối (số Proton + số Nơtron).Z là số hiệu nguyên tử.Công thức tính
Số đơn vị điện tích hạt nhân:
Z = số proton (P) = số electron (E)Z = p = ESố khối của hạt nhân:
A = Số proton (Z) + số nơtron (N)A = Z + NTổng những hạt vào nguyên tử = phường + E + N
Công thức tính nguyên tử khối trung bình:
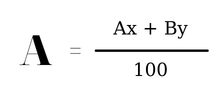
Trong đó:
A, B theo thứ tự là nguyên tử khối của hai đồng vị A cùng Bx, y lần lượt là tỉ lệ xác suất số nguyên tử của từng đồng vị A cùng B.Cách khẳng định phần trăm những đồng vị:
Gọi % của đồng vị một là x %⇒ % của đồng vị 2 là (100 – x).
Lập phương trình tính nguyên tử khối vừa đủ ⇒ giải được x.Công thức tính thể tích nguyên tử:
V = 4/3πr³ (r là bán kính nguyên tử)
Khối lượng riêng của nguyên tử:
D = m/V
1 mol nguyên tử đựng N = 6,023 x 10 nón 23 nguyên tử.Chương 2: Bảng tuần hoàn những nguyên tố hóa học – Định quy định tuần hoàn
Trước khi khám phá các công thức hóa học tập lớp 10 vào chương 2, bọn họ cùng hệ thống lại kiến thức và kỹ năng về vị trí nguyên tố vào bảng tuần trả nhé!
Vị trí yếu tố trong bảng tuần hoàn
Số vật dụng tự ô thông qua số hiệu nguyên tử thông qua số proton ngay số electron.Số sản phẩm tự chu kì bằng số lớp electron.Số thiết bị tự nhóm thông qua số electron hóa trị.Các bí quyết tạo bởi vì nguyên tố R, thuộc nhóm n
A trong bảng tuần hoàn
Với n là số máy tự của nhóm.Công thức hợp chất khí với hydro:RH8- n
Với n là số sản phẩm công nghệ tự của nhóm.
Trong cùng chu kỳ, khi điện tích hạt nhân tăng, hóa trị cao nhất với oxi tăng từ là 1 đến 7, hóa trị so với hydro sút từ 4 cho 1.
Chương 3: links hóa học
Các cách làm hóa học lớp 10 trong chương 3 – liên kết hóa học gồm:
Hiệu độ âm điện và liên kết hóa học
Xét đúng theo chất bao gồm CTHH dạng Ax
By
Hiệu độ âm điện:
Δx
A – B = |x
A – x
B|
Nếu:
0 ≤ ΔxA – B 0,4 ≤ Δx
A – B Δx
A – B ≥ 1,7: links ion.
Cách khẳng định số oxi hóa
Quy tắc 1: Số oxi hóa của những nguyên tố trong những đơn chất bởi 0 (VD: H2, O2, N2,…).Quy tắc 2: trong một phân tử, tổng số oxi hóa của các nguyên tố bằng 0.Quy tắc 3: các ion đối chọi nguyên tử bao gồm số oxi hóa bằng điện tích của ion đó. Trong ion đa nguyên tử, tổng cộng oxi hóa của các nguyên tố bằng điện tích của ion.Quy tắc 4: Trong phù hợp chất, số lão hóa của Hydro bằng +1 (trừ trường đúng theo như hydrua, kim loại như NaH, Ca
H2,… gồm số oxi hóa bằng −1). Số oxi hóa của Oxy bởi −2 (trừ trường vừa lòng F2O, peoxit như H2O2, Na2O2).
Chương 4: phản nghịch ứng thoái hóa – khử
Phản ứng oxi hoá – khử là phản nghịch ứng hoá học nhưng ở kia đó có sự chuyển electron giữa các chất tham gia vào bội nghịch ứng. Hay nói phương pháp khác, đó là phản ứng bao gồm sự biến hóa số oxi hoá của một số nguyên tố.
Vậy các công thức hóa học lớp 10 trong phản bội ứng thoái hóa – khử là gì, thuộc Thư Viện Hỏi Đáp mày mò ngay nào.
Định cách thức bảo toàn electron
∑ne dường = ∑ne nhận
Cân bằng phương trình bội phản ứng oxi hóa – khử bằng phương pháp thăng bằng electron
Bước 1: khẳng định số oxi hóa cùng ghi số oxi hoá của rất nhiều nguyên tố có số oxi hoá ráng đổi.Bước 2: Viết phương trình làm phản ứng và cân nặng bằng.Bước 3: kiếm tìm hệ số tương thích của hóa học oxi hóa và hóa học khử thế nào cho tổng số electron nhường bởi với toàn bô electron nhận.Chương 5: team halogen
Nhóm halogen thuộc đội VII A trong bảng tuần hoàn các nguyên tố hóa học. Nhóm halogen gồm các nguyên tố Clo (Cl), Flo (F), Brom (Br) với Iot (I).
Công thức tính cân nặng muối thu được lúc cho kim loại phản ứng hết với HCl:
m muối = m KL + m cội axit
Công thức tính trọng lượng muối clorua thu được lúc toàn tan hết hỗn kim loại tổng hợp loại bởi HCl giải phóng H2:
m muối hạt clorua = m tất cả hổn hợp KL + 71.n
H2
Chương 6: Oxi – lưu lại huỳnh
Các phương pháp hóa học tập lớp 10 chương Oxi – lưu huỳnh gồm:
Khối lượng muối hạt sunfat thu được khi hoà tan không còn hỗn kim loại tổng hợp loại bằng H2SO4 loãng giải hòa H2:m muối sunfat = m tất cả hổn hợp KL + 96.n
H2
m muối bột sunfat = m hỗn hợp KL + 80.n
H2SO4
m muối hạt = m tất cả hổn hợp KL + 96.n
SO2
m muối bột = m hỗn hợp KL + 96.(n
SO2 + 3n
S + 4n
H2S)
Chương 7: vận tốc phản ứng – thăng bằng hóa học
Tốc độ phản ứng
Tốc độ phản nghịch ứng là sự thay đổi (độ biến chuyển thiên) nồng độ của chất phản ứng hoặc sản phẩm trong một đơn vị chức năng thời gian.
Xét một phản ứng bao gồm sự tham gia của chất A từ thời khắc t1 cho t2.
Tốc độ bội nghịch ứng của A là:
Δv = – ΔC/Δt
Trong đó:
ΔC: Độ thay đổi thiên nồng độ của chất (lấy trị hay đối)Δt: Khoảng thời hạn xảy ra sự thay đổi thiên nồng độ.Nếu vận tốc phản ứng tính theo thành phầm B thì:
v = ΔC/Δt
Do đó, công thức tổng thể tính vận tốc phản ứng trong khoảng thời hạn từ t1 cho t2:
v = ± ΔC/Δt
Biểu thức vận tốc phản ứng:
v = k.a.b
Trong đó:
k: Hằng số tỉ lệ (hằng số vận tốc)., : Nồng độ mol chất A, BĐộ đổi mới thiên nồng độ (ΔC) của những chất trong phản nghịch ứng có thể khác nhau. Vận tốc phản ứng của từng chất rất có thể khác nhau.
Cân bằng hóa học
Xét phản nghịch ứng thuận nghịch: a
A + b
B ↔ c
C + d
D, ta có:
Phản ứng sinh sống trạng thái cân nặng bằng:
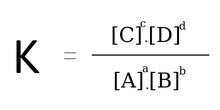
Lưu ý: Đối với phản ứng có chất rắn thì ko viết nồng độ chất rắn vào biểu thức tính K.
Như vậy, tủ sách Hỏi Đáp đã giúp cho bạn củng cố những công thức hóa học lớp 10. Ngoài câu hỏi nắm vững những kiến thức về mặt kim chỉ nan thì vấn đề rèn luyện các bài tập vận dụng là điều thiết yếu. Thuộc Thư Viện Hỏi Đáp giải một trong những bài tập vận dụng ngay nào.

C là gì trong Hóa học? Tổng hợp những công thức liên quan
Bài tập vận dụng các công thức hóa học lớp 10
Bài 1: Tổng số phân tử cơ bạn dạng của 1 nguyên tử X là 82, trong số đó tổng số hạt với điện nhiều hơn nữa số phân tử không mang điện là 22. Khẳng định X.
Hướng dẫn giải:
Ta có: p. + N + E = 82
⇒ 2P + N = 82 (1) (Vì p = E)
Mà tổng thể hạt với điện nhiều hơn thế nữa số phân tử không sở hữu điện là 22, nên
2P – N = 22 (2)
Từ (1) và (2) ⇒ p = E = 26, N = 30
⇒ A = p. + N = 56
Vậy X là Fe
Bài 2 Khi đun cho nóng 11,07g KMn
O4 ta được 10,11g buồn phiền rắn A và hóa học khí B. Tính thể tích B làm việc (đktc) được giải phóng?
Hướng dẫn giải:
PTHH: KMn
O4 → K2Mn
O4 + Mn
O2 + O2
Áp dụng định hình thức bảo toàn khối lượng:
m
B = 11,07 – 10,11 = 0,96 (g) = m
O2
n
O2 = m/M = 0,96/32 = 0,03 (mol)
VO2 = n x 22,4 = 0,03 x 22,4 = 0,672 (lít)
Bài 3: Hòa tan trọn vẹn 19,2 gam Cu bởi dung dịch HNO3 thu được V lít khí NO ngơi nghỉ đktc (NO là sản phẩm khử duy nhất). Tìm cực hiếm của V.
Hướng dẫn giải:
n
Cu = 19,2/64 = 0,3 (mol)
Ta có:
Cu (0) → Cu(+2) + 2e
N(+5) + 3e → N(+2)
Cứ 1 mol Cu sẽ nhường 2e, cho nên vì vậy 0,3 mol Cu đã nhường 0,3 x 2 = 0,6 mol
Giải sử số mol NO đề nghị tìm là X thì số e để tạo thành X mol NO là 3X
Áp dụng định mức sử dụng bảo toàn electron:
∑ne nhường nhịn = ∑ne nhận ⇔ 0,6 = 3X ⇒ X = 0,2
⇒ V = 0,2 x 22,4 = 4,48 (lít)
Bài 4: hòa hợp hết 11,1 gam các thành phần hỗn hợp 3 sắt kẽm kim loại trong dung dịch H2SO4 loãng dư thu được hỗn hợp A và 8,96 lít khí làm việc đktc. Cô cạn dung dịch A được m gam muối hạt khan. Tính m?
Hướng dẫn giải:
Theo đề ta có:
n
H2 = V/22,4 = 8,96/22,4 = 0,4 (mol)
Áp dụng công thức: m muối hạt = m
KL + 96.n
H2 = 11,1 + 96.0,4 = 11,1 + 38,4 = 49,5 (g)

Trên đấy là tất cả các công thức hóa học lớp 10 nhưng Thư Viện Hỏi Đáp chia sẻ với bạn. Mong muốn các công thức hóa học lớp 10 đang là bước đệm giúp bạn tiếp thu kiến thức mới trong lớp 11 xuất sắc hơn. Chúc các bạn học giỏi và đừng quên theo dõi thư viện Hỏi Đáp hằng ngày nhé!
Tổng hợp những công thức hóa học lớp 10 đầy đủ, chi tiết nhất
Để giúp chúng ta nắm vững kiến thức và kỹ năng và làm bài xích tập tốt, thư viện Hỏi Đáp share đến bạn các công thức chất hóa học lớp 10 đầy đủ, chi tiết nhất. Hãy xem thêm ngay nhé!Trong bài viết hôm nay, thư viện Hỏi Đáp có đến cho chính mình đọc những kiến thức và kỹ năng về các công thức chất hóa học lớp 10 đầy đủ, chi tiết nhất. Hy vọng đây đã là cuốn sổ tay công thức khiến cho bạn học xuất sắc môn hóa học lớp 10 nhé!Các phương pháp hóa học lớp 10 đầy đủ, chi tiết nhất
Nội dung chương trình Hóa học tập lớp 10 có tương đối nhiều kiến thức và công thức cần nhớ khiến bạn phải đau đầu. Vì thế, thư viện Hỏi Đáp để giúp bạn tổng hợp những công thức chất hóa học lớp 10 trong từng chương một biện pháp đầy đủ, cụ thể nhất.Chương 1: Nguyên tử
Công thức đầu tiên trong nội dung những công thức hóa học lớp 10 kia là phương pháp tính nguyên tử. Thành phần cấu tạo nguyên tử có hạt nhân (số Proton + số Nơtron ) với vỏ nguyên tử (Electron).Ký hiệu nguyên tử
Trong đó:X là kí hiệu hóa học.A là số khối (số Proton + số Nơtron).Z là số hiệu nguyên tử.Công thức tính
Số đơn vị điện tích hạt nhân:Z = số proton (P) = số electron (E)Z = p. = ESố khối của phân tử nhân:A = Số proton (Z) + số nơtron (N)A = Z + NTổng những hạt trong nguyên tử = p + E + NCông thức tính nguyên tử khối trung bình:
Trong đó:A, B theo thứ tự là nguyên tử khối của nhì đồng vị A với Bx, y lần lượt là tỉ lệ phần trăm số nguyên tử của mỗi đồng vị A và B.Cách xác minh phần trăm những đồng vị:Gọi % của đồng vị 1 là x %⇒ % của đồng vị 2 là (100 – x).Lập phương trình tính nguyên tử khối mức độ vừa phải ⇒ giải được x.Công thức tính thể tích nguyên tử:V = 4/3πr³ (r là nửa đường kính nguyên tử)Khối lượng riêng rẽ của nguyên tử:D = m/V1 mol nguyên tử đựng N = 6,023 x 10 mũ 23 nguyên tử.Chương 2: Bảng tuần hoàn những nguyên tố chất hóa học – Định lao lý tuần hoàn
Trước khi khám phá các bí quyết hóa học lớp 10 vào chương 2, họ cùng hệ thống lại kỹ năng và kiến thức về địa chỉ nguyên tố vào bảng tuần hoàn nhé!Vị trí yếu tắc trong bảng tuần hoàn
Số sản phẩm tự ô bằng số hiệu nguyên tử bằng số proton thông qua số electron.Số thứ tự chu kì thông qua số lớp electron.Số đồ vật tự nhóm bằng số electron hóa trị.Các công thức tạo bởi nguyên tố R, thuộc nhóm n
A vào bảng tuần hoàn
Công thức oxit cao nhất:R2On
Với n là số sản phẩm tự của nhóm.
Công thức hợp hóa học khí cùng với hydro:RH8- n
Với n là số vật dụng tự của nhóm.
Trong thuộc chu kỳ, khi điện tích hạt nhân tăng, hóa trị tối đa với oxi tăng từ là 1 đến 7, hóa trị đối với hydro bớt từ 4 mang đến 1.Chương 3: link hóa học
Các phương pháp hóa học tập lớp 10 trong chương 3 – liên kết hóa học tập gồm:Hiệu độ âm điện và link hóa học
Xét hợp chất có CTHH dạng Ax
By
Hiệu độ âm điện:Δx
A – B = |x
A – x
B|Nếu:0 ≤ Δx
A – B 0,4 ≤ Δx
A – B Δx
A – B ≥ 1,7: links ion.Cách khẳng định số oxi hóa
Quy tắc 1: Số oxi hóa của những nguyên tố trong những đơn chất bởi 0 (VD: H2, O2, N2,…).Quy tắc 2: trong 1 phân tử, toàn bô oxi hóa của những nguyên tố bởi 0.Quy tắc 3: các ion solo nguyên tử có số oxi hóa bởi điện tích của ion đó. Vào ion nhiều nguyên tử, toàn bô oxi hóa của những nguyên tố bởi điện tích của ion.Quy tắc 4: Trong phù hợp chất, số oxi hóa của Hydro bởi +1 (trừ trường hợp như hydrua, kim loại như Na
H, Ca
H2,… có số oxi hóa bằng −1). Số oxi hóa của Oxy bằng −2 (trừ trường hợp F2O, peoxit như H2O2, Na2O2).Chương 4: bội nghịch ứng thoái hóa – khử
Phản ứng oxi hoá – khử là phản nghịch ứng hoá học cơ mà ở kia đó bao gồm sự đưa electron giữa các chất gia nhập vào bội phản ứng. Tuyệt nói giải pháp khác, đó là phản ứng bao gồm sự chuyển đổi số oxi hoá của một số nguyên tố.Vậy các công thức hóa học lớp 10 trong phản bội ứng lão hóa – khử là gì, cùng Thư Viện Hỏi Đáp tò mò ngay nào.Định khí cụ bảo toàn electron∑ne dường = ∑ne nhận
Cân bằng phương trình bội nghịch ứng oxi hóa – khử bằng phương pháp thăng bằng electron
Bước 1: xác định số oxi hóa cùng ghi số oxi hoá của không ít nguyên tố tất cả số oxi hoá vắt đổi.Bước 2: Viết phương trình phản nghịch ứng và cân bằng.Bước 3: tra cứu hệ số thích hợp của chất oxi hóa và chất khử làm sao để cho tổng số electron nhường bằng với toàn bô electron nhận.Chương 5: team halogen
Nhóm halogen thuộc đội VII A vào bảng tuần hoàn các nguyên tố hóa học. Nhóm halogen gồm các nguyên tố Clo (Cl), Flo (F), Brom (Br) và Iot (I).Công thức tính khối lượng muối thu được lúc cho kim loại phản ứng hết với HCl:m muối hạt = m KL + m cội axit
Công thức tính khối lượng muối clorua thu được khi toàn tan không còn hỗn hợp kim loại bằng HCl hóa giải H2:m muối clorua = m tất cả hổn hợp KL + 71.n
H2Chương 6: Oxi – lưu huỳnh
Các cách làm hóa học lớp 10 chương Oxi – lưu hoàng gồm:Khối lượng muối bột sunfat thu được lúc hoà tan không còn hỗn kim loại tổng hợp loại bằng H2SO4 loãng giải hòa H2:m muối sunfat = m hỗn hợp KL + 96.n
H2Khối lượng muối sunfat thu được lúc hoà chảy hết hỗn hợp oxit kim loại bằng H2SO4 loãng:m muối bột sunfat = m các thành phần hỗn hợp KL + 80.n
H2SO4Khối lượng muối hạt sunfat thu được khi hoà tan không còn hỗn hợp các kim loại bằng H2SO4 đặc, nóng hóa giải khí SO2:m muối hạt = m hỗn hợp KL + 96.n
SO2Khối lượng muối sunfat thu được lúc hoà tan hết hỗn hợp những kim loại bởi H2SO4 đặc, nóng hóa giải khí SO2, S, H2S:m muối = m các thành phần hỗn hợp KL + 96.(n
SO2 + 3n
S + 4n
H2S)Chương 7: tốc độ phản ứng – thăng bằng hóa học
Tốc độ phản bội ứng
Tốc độ bội phản ứng là sự thay đổi (độ trở thành thiên) nồng độ của chất phản ứng hoặc sản phẩm trong một đơn vị thời gian.Xét một bội phản ứng tất cả sự tham gia của hóa học A từ thời khắc t1 đến t2.Tốc độ phản ứng của A là:Δv = – ΔC/Δt
Trong đó:ΔC: Độ đổi mới thiên độ đậm đặc của chất (lấy trị hay đối)Δt: Khoảng thời gian xảy ra sự thay đổi thiên nồng độ.Nếu tốc độ phản ứng tính theo thành phầm B thì:v = ΔC/Δt
Do đó, công thức tổng thể tính tốc độ phản ứng trong khoảng thời hạn từ t1 đến t2:v = ± ΔC/Δt
Biểu thức tốc độ phản ứng:v = k.a.b
Trong đó:k: Hằng số tỉ lệ (hằng số vận tốc).
Xem thêm: Công thức hóa học của axit nitric là, cấu tạo, tính chất và ứng dụng
, : Nồng độ mol chất A, BĐộ đổi mới thiên độ đậm đặc (ΔC) của các chất trong phản bội ứng rất có thể khác nhau. Tốc độ phản ứng của từng chất có thể khác nhau.Cân bằng hóa học
Xét phản bội ứng thuận nghịch: a
A + b
B ↔ c
C + d
D, ta có:Phản ứng thuận: A + B → C + D.Phản ứng nghịch: C + D → A + B.Phản ứng ngơi nghỉ trạng thái cân nặng bằng:
Lưu ý: Đối với bội nghịch ứng có chất rắn thì ko viết nồng độ hóa học rắn vào biểu thức tính K.Như vậy, tủ sách Hỏi Đáp đã giúp đỡ bạn củng cố những công thức chất hóa học lớp 10. Ngoài việc nắm vững những kiến thức về mặt kim chỉ nan thì vấn đề rèn luyện các bài tập áp dụng là điều thiết yếu. Thuộc Thư Viện Hỏi Đáp giải một vài bài tập vận dụng ngay nào.
C là gì vào Hóa học? Tổng hợp các công thức liên quanBài tập vận dụng những công thức hóa học lớp 10Bài 1: Tổng số hạt cơ phiên bản của 1 nguyên tử X là 82, trong các số đó tổng số hạt mang điện nhiều hơn thế số hạt không sở hữu điện là 22. Xác định X.Hướng dẫn giải:Ta có: p. + N + E = 82⇒ 2P + N = 82 (1) (Vì phường = E)Mà toàn bô hạt mang điện nhiều hơn số phân tử không sở hữu điện là 22, nên2P – N = 22 (2)Từ (1) và (2) ⇒ p = E = 26, N = 30⇒ A = phường + N = 56Vậy X là Fe
Bài 2 Khi đun nóng 11,07g KMn
O4 ta được 10,11g buồn phiền rắn A và chất khí B. Tính thể tích B sinh hoạt (đktc) được giải phóng?
Hướng dẫn giải:PTHH: KMn
O4 → K2Mn
O4 + Mn
O2 + O2Áp dụng định phương tiện bảo toàn khối lượng:m
B = 11,07 – 10,11 = 0,96 (g) = m
O2n
O2 = m/M = 0,96/32 = 0,03 (mol)VO2 = n x 22,4 = 0,03 x 22,4 = 0,672 (lít)Bài 3: Hòa tan trọn vẹn 19,2 gam Cu bởi dung dịch HNO3 chiếm được V lít khí NO làm việc đktc (NO là thành phầm khử duy nhất). Tìm quý giá của V.Hướng dẫn giải:n
Cu = 19,2/64 = 0,3 (mol)Ta có:Cu (0) → Cu(+2) + 2eN(+5) + 3e → N(+2)Cứ 1 mol Cu đã nhường 2e, cho nên vì thế 0,3 mol Cu đang nhường 0,3 x 2 = 0,6 mol
Giải sử số mol NO nên tìm là X thì số e để tạo nên X mol NO là 3XÁp dụng định điều khoản bảo toàn electron:∑ne dường = ∑ne nhấn ⇔ 0,6 = 3X ⇒ X = 0,2⇒ V = 0,2 x 22,4 = 4,48 (lít)Bài 4: tổ hợp hết 11,1 gam hỗn hợp 3 sắt kẽm kim loại trong hỗn hợp H2SO4 loãng dư thu được hỗn hợp A với 8,96 lít khí nghỉ ngơi đktc. Cô cạn dung dịch A được m gam muối hạt khan. Tính m?
Hướng dẫn giải:Theo đề ta có:n
H2 = V/22,4 = 8,96/22,4 = 0,4 (mol)Áp dụng công thức: m muối hạt = m
KL + 96.n
H2 = 11,1 + 96.0,4 = 11,1 + 38,4 = 49,5 (g)
Trên đấy là tất cả những công thức hóa học lớp 10 nhưng mà Thư Viện Hỏi Đáp share với bạn. Hy vọng các công thức hóa học lớp 10 đã là cách đệm khiến cho bạn tiếp thu kiến thức mới vào lớp 11 xuất sắc hơn. Chúc các bạn học giỏi và đừng quên theo dõi tủ sách Hỏi Đáp hằng ngày nhé!
#Tổng #hợp #các #công #thức #hóa #học #lớp #đầy #đủ #chi #tiết #nhất
Tổng hợp: tủ sách Hỏi Đáp#Tổng #hợp #các #công #thức #hóa #học #lớp #đầy #đủ #chi #tiết #nhấtTrang chủ: giaoducq1.edu.vn danh mục bài: Tổng hợp