toàn bộ những công thức hóa học tập lớp 8
I. CÔNG THỨC TÍNH SỐ MOL (MOL)1. Theo khối lượng:n = m/MTrong đó:m: khối lượngM: trọng lượng phân tử, cân nặng mol
Ví dụ 1Cho 2,4 gam Mg vào dung dịch HCl dư. Tính thể tích khí hiđrô thu được sinh sống điều kiệnchuẩn. (Cho Mg=24)2. Theo thể tích (đối với chất khí ở đk chuẩn) :n =V/22,4Trong đó:V: thể tích khí
Ví dụ 2Cho 6,75 gam sắt kẽm kim loại nhôm vào dung dịch H2SO4 loãng . Bội nghịch ứng kết thúc thu được3,36 lít khí (đktc).a. Viết phương trình phản ứng.b. Tính cân nặng muối thu được sau phản nghịch ứng.(Cho: Zn = 65; H = 1; S = 32; O = 16)II. CÔNG THỨC TÍNH NỒNG ĐỘ DUNG DỊCH
1. Mật độ mol /lít (CM)CM =n/V (M)

Ví dụ 3
Để trung hoà hết 200 gam dung dịch Na
OH 10% đề xuất dùng bao nhiêu gam hỗn hợp HCl 3,65%.
Bạn đang xem: Các công thức hóa học lớp 8 cần nhớ
(cho na = 23; Cl = 35,5; O = 16; H = 1)
Ví dụ 4
Cho 200ml hỗn hợp Na
OH 8% gồm D = 1,15g/ml tính năng với 380 gam hỗn hợp Mg
Cl25%.
Thế là ngừng nhé các bạn
Các công thức được chụp bởi hình là
Công thức liện hệ C%, CM, khối lượng riêng D
Công thức tính trọng lượng riêng (D)
Nồng độ phần trăm
Công thức tính nguyên tố phần trăm
Phần trăm theo khối lượng:Phần trăm theo cố kỉnh tích (chính là phần trăm theo số mol):Các công thức hóa học tập lớp 8, 9 cơ bản cần nhớ
Các cách làm hóa học tập lớp 8 cơ bản cần nhớ có có: bí quyết tính số Mol, cách làm tính nồng độ Mol, phương pháp tính mật độ %, bí quyết tính khối lượng, công thức tính thể tích dung dịch…
21 cách làm hóa học tập lớp 8, 9 buộc phải nhớ


⚗️ GIA SƯ HÓA
Tổng hợp những công thức chất hóa học lớp 8 đề xuất nhớ – chuyên đề 1
Môn chất hóa học lớp 8 giới thiệu đến những em những kỹ năng căn bản nhất của môn Hóa học. Cố kỉnh nào là chất, cố gắng nào là thành phần hóa học. Nguyên tử và phân tử khác nhau ở đâu. Tuy nhiên song với đó, các em cũng trở nên được học một trong những công thức hóa học.
Dưới đó là tổng hợp những công thức chất hóa học lớp 8 buộc phải nhớ ở trong chương trang bị nhất: hóa học – Nguyên tử – Phân tử – Hóa trị. Rõ ràng là những công thức liên quan đến trọng lượng nguyên tử, trọng lượng phân tử, luật lệ hóa trị của một chất.
1, Tổng hợp các các bí quyết hóa học lớp 8 cần nhớ – Phần 1: chất – Nguyên tửKiến thức trung tâm về Chất
Chất có ở mọi nơi, chỗ nào có đồ gia dụng thể, sống đó có chất.
Vật thể vì chưng một chất hoặc những chất chế tạo ra nên. Ví dụ như ấm nhôm do nhôm sinh sản nên, xe đạp do những chất sắt, nhôm, cao su đặc tạo nên.
Mỗi một chất lại sở hữu những tính chất vật lí và đặc thù hóa học độc nhất định. Ví dụ như nước sôi ở 100 độ C cùng đông sệt ở 0 độ C. Đường gồm vị ngọt, đồng tất cả màu đỏ
Hỗn hợp: nhì hay các chất trộn lẫn vào cùng nhau thì gọi là lếu hợp. để ý rằng, nước tự nhiên gồm những chất trộn lẫn là 1 hỗn hợp. Còn nước chứa là chất tinh khiết
Tách chất ra khỏi hỗn hợp: dựa vào sự không giống nhau về đặc thù vật lý như tính tan, ánh sáng sôi của các chất gồm thể tách được một chất thoát khỏi hỗn hợp
Kiến thức trọng tâm về Nguyên tử
Nguyên trường đoản cú được quan niệm là hạt vô cùng nhỏ dại và th-nc về điện.
Cấu sản xuất của nguyên tử gồm có vỏ nguyên tử cùng hạt nhân nguyên tử
Hạt nhân nguyên tử gồm bao gồm 3 một số loại hạt là hạt proton sở hữu điện tích dương, hạt notron không mang điện với hạt electron có điện tích âm.
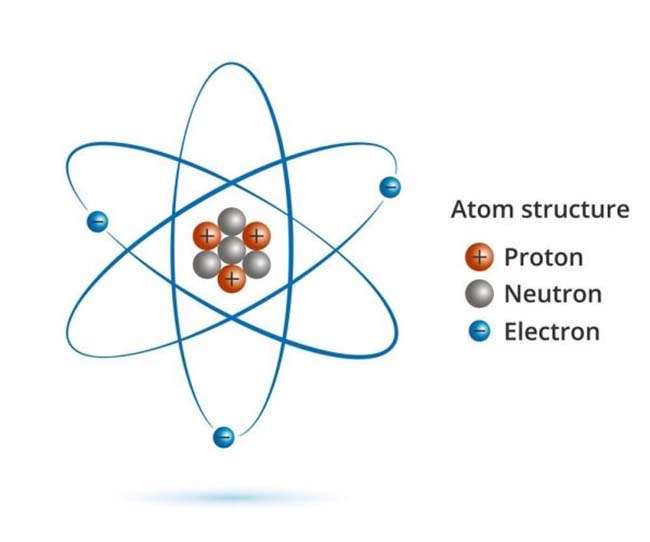
Đặc điểm và công thức hạt nhân nguyên tử
Nguyên tử th-nc về điện đề xuất số proton ngay số electron. Ta có công thứcp = e.Đây là một trong những trongcác bí quyết hóa học tập cơ phiên bản thcsElectron luôn hoạt động quanh hạt nhân và thu xếp thành từng lớpProton cùng notron tất cả cùng khối lượng. Ta tất cả công thức: m (p) = m (n)electron có khối lượng rất nhỏ bé không đáng kể, nên cân nặng hạt nhân cũng là cân nặng hạt nhân. Ta có công thức: m (nguyên tử) = m (hạt nhân)
Kiến thức trọng tâm về nhân tố hóa học
Nguyên tố hóa học: Là tập hợp đều nguyên tử thuộc loại,có thuộc số proton trong phân tử nhân. Từng nguyên tố chất hóa học lại được màn trình diễn bằng một kí hiệu hóa học. Ví dụ: Na, K, S, Cl, Fe
Nguyên tử khối là trọng lượng của một nguyên tử tính bằng đơn vị chức năng cacbon. Mỗi nguyên tử gồm một trọng lượng riêng biệt,
Đơn vị cacbon (đv
C): 1 đv
C = 1/12 m (Cacbon)
Trong đó khối lượng nguyên tử C – m (Cacbon) = 1, 9926. 10-23
2, Tổng hợp các các bí quyết hóa học tập lớp 8 buộc phải nhớ – Phần 2: Phân tử
Phân tử là thay mặt cho chất, gồm một trong những nguyên tử liên kết với nhau và thể hiện không thiếu tính hóa chất của chất
Phân tử bao gồm hai dạng là 1-1 chất với hợp chất
Đơn chất: là phần nhiều chất làm cho từ một nhân tố hóa học. Khí Hidro (H2) là đối kháng chất, được tạo cho từ 1 nguyên tố chất hóa học là hidro. Trong đối chọi chất lại được tạo thành 2 các loại là solo chất sắt kẽm kim loại và đối chọi chất phi kim. Đơn chất kim loại có tính dẻo, tính dẫn điện, tính dẫn nhiệt, ánh kim,…Hợp chất: là hồ hết chất tạo cho từ nhị nguyên tố chất hóa học trở lên. NaCl là hòa hợp chất, được tạo nên từ 2 yếu tố hóa học đó là natri (Na) và clo (Cl)
công thức hóa học đầy đủtính cân nặng phân tử:
Phân tử khối = cân nặng phân tử (đv
C) = tổng số nguyên tử thành phần . Nguyên tử khối
Ví dụ đối kháng chất: Phân tử ni tơ gồm 2 nguyên tử N. Vậy phân tử khối của ni tơ được tính bằng 2 lần nguyên tử khối của nguyên tử N và bằng 2.14 = 28 (đv
C)
Ví dụ hợp chất: Một phân tử axit clohidric (HCl) được cấu tạo từ 1 nguyên tử Hidro (H) và một nguyên tử Clo (Cl). Vậy phân tử khối của axit clohidric được xem bằng tổng của nguyên tử khối của H và Cl và bởi 1 + 35,5 = 36,5 (đv
C)
Công thức hóa học của đơn chất được kí hiệu bên dưới 2 dạng là A với Ax
Trong kia A thường xuyên là đơn chất kim loại với một vài ba phi kim, ví dụ như Na, Fe, Cu, P, C, SCòn Axthường là 1-1 chất phi kim, gồm 2 nguyên tử link với nhau: O2, H2, N2Công thức hóa học của thích hợp chất gồm công thức Ax
By
Cz
Trong đó A, B, C là các kí hiệu chất hóa học còn x, y, z là những chỉ số chân, cho thấy số nguyên tử của nguyên tố có trong một phân tử
Ý nghĩa của phương pháp hóa học: cách làm hóa học tập của mỗi chất cho biết
Số nguyên tố tạo thành chấtSố nguyên tử của từng nguyên tố
Phân tử khối
Ví dụ: axit sunfuric bao gồm công thức hóa học là H2SO4
Vậy axit sunfuric vì chưng 3 thành phần H, S, O sản xuất ra
Trong 1 phân tử axit sunfuric bao gồm 2 nguyên tử H, 1 nguyên tử S cùng 4 nguyên tử O
Phân tử khối của 1 phân tử axit sunfuric bằng 2.1 + 1.32 + 4.16 = 98 (đv
C)
Hóa trị của một nhân tố (hay một đội nguyên tử) là bé số biểu thị khả năng link của nguyên tử (hay đội nguyên tử), được xác định theo
Hóa trị của H, hóa trị của H được chọn làm đối kháng vị, hóa trị của H là một trong đơn vị
Hóa trị của O là 2 đơn vị
Quy tắc hóa trị: Ax
By-> a.x = b.y
Đây là bí quyết hóa trị cơ phiên bản nhất, từ phương pháp này, ta cócác công thức hóa học lớp 9liên quan mang đến hóa trị sau này
Trong đó
a, b là hóa trị của nguyên tố.
x, y là chỉ số tốt số nguyên tử của nguyên tố
5, bài bác tập vận dụng một số các cách làm hóa học lớp 8 yêu cầu nhớBài tập 1: Tổng số hạt proton, notron, electron vào nguyên tử là 28 hạt, trong những số ấy số phân tử không với điện là 10. Tính số hạt mỗi loại
Hướng dẫn giải
Hạt không có điện là notron, vậy n = 10
Tổng số phân tử proton, notron với electron trong nguyên tử là 28 yêu cầu ta áp dụngcác công thức hóa học lớp 8 đề xuất nhớcó p + n + e = 28 (1)
Vì số proton ngay số electron nên từ (1) ta gồm 2p + n = 28, mà n = 10 phải ta gồm số phường = số e = 9
Vậy ta tất cả số hạt proton với electron là 9, số notron là 10
Bài tập 2: a) Tính phân tử khối của mỗi hóa học sau: axit nitric, canxi sunfat, fe III oxit, bari hidroxit
b) xác minh % khối lượng của oxi trong mỗi phân tử trênHướng dẫn giải
a) axit nitric: HNO3có phân tử khối là M = 1 + 14 + 3.16 = 63 (đvC)
canxi sunfat: Ca
SO4có phân tử khối là M = 40 + 32 + 4.16 = 120 (đv
C)
sắt III oxit: Fe2O3có phân tử khối là M = 56.2 + 16.3 = 160 (đv
C)
bari hidroxit Ba(OH)2có phân tử khối là M = 137 + 2.(16+1) = 171 (đv
C)
% Oxi trong canxi sunfat là: 4.16 / 120 = 53,33%
% Oxi trong sắt III oxit là: 16.3 / 160 = 30%
% Oxi trong bari hidroxit: 32 / 171 = 18,71%
Trên đây là toàn bộcác công thức hóa học lớp 8 yêu cầu nhớliên quan đến chương thứ nhất của hóa học lớp 8: chất – Nguyên tử – Phân tử – Hóa trị. Để hoàn toàn có thể làm được các bài tập của phần này, những em học sinh cần cầm được những bí quyết tổng đúng theo trong bài cũng tương tự xem kĩ lại các bài tập ví dụ đã có giải cụ thể phía trên.
Công thức hóa học | bài bác tập lập cách làm hóa học giả dụ biết hóa trị
Lập công thức Hóa học là một trong tương đối nhiều dạng bài cơ bản khi học môn chất hóa học lớp 8 có hướng dẫn giải đầy đủ. Chúng ta cần cố được cách làm với một số lưu ý rất quan trọng đặc biệt thì lập phương pháp hóa học tập nhanh, đúng chuẩn rất những
1. Lập công thức của đối kháng chất
Lập công thức hóa học tập của Kim loạiCông thức hóa học được phân thành các các loại như bí quyết hóa học tập của kim loại thường trùng với cam kết hiệu hóa học của kim loại đó
Ví dụ:Công thức chất hóa học của Natrium là Na
Công thức hóa học của Kalium là KCông thức hóa học của Canxium là Ca
Công thức hóa học của sắt là sắt
Công thức hóa học của phi kim thường tồn tại sống dạng khí nên những lúc thể hiện nay trên cách làm hóa học họ thường có hai nguyên tử của yếu tố phi kim link với nhau
Ví dụ:Công thức chất hóa học của Hidro là H2Công trang bị hóa học tập của Clo là Cl2Công thức hóa học của Nitơ là N2Công thức hóa học của Oxy là O2Một số quy cầu khác, cách làm hóa học phi kim cũng hoàn toàn có thể là ký hiệu hóa học
Ví dụ:Công thức hóa học của Cácbon là CCông thức hóa học của Phốt pho là PCông thức chất hóa học của hòa hợp chất
Công thức chất hóa học của diêm sinh là S
2. Lập công thức của hòa hợp chất
Hợp hóa chất là tất cả hổn hợp được làm cho bởi nhì hoặc những nguyên tố hóa học khác nhau.Khi họ lập cách làm của hợp chất hóa học chúng ta cần phải nắm vững được luật lệ hóa trị.Hóa trị là gì?Hóa trị làcủa một thành phần được xác minh bằng số links hóa học mà lại một nguyên tử của thành phần đó tạo cho trong phân tử
Quy tắc hóa trị là gì ?Xét một hợp chất hóa học tất cả công thức tổng quát

3. Bài tập lập cách làm Hóa Học
Bài 1: Lập bí quyết Hóa Học của những hợp hóa học sau đây:a. Lập phương pháp hóa học tập của Cu(II) với Clo sản xuất thành hợp chất Đồng Clorua

Theo luật lệ hóa trị ta có: 2x=y
Chọn x=1, y=2 ta được bí quyết hóa học tập của đồng clorua là

b. Lập bí quyết hóa học thân Al cùng (NO3) tạo thành thành chất Nhôm Nitơrát

– Theo quy tác hóa trị ta có: 3x=y
Chọn x=1, y=3 ta được cách làm hóa học tập của Nhôm Nitơrát là

c.Lập phương pháp hóa học của canxi Phốt phát đựng nguyên tố Ca cùng nhóm phốt vạc (PO4) gồm số hóa trị là 3Bài giải:– Gọi bí quyết hóa học tập của hợp hóa học là

– Theo quy tắc hóa trị ta có: 2x=3y
Chọn x=3, y=2 ta được phương pháp Hóa học của can xi photphat là

Bài 2: Lập công thức hóa học của sắt có hóa trị tương xứng trong công thức Fe
Cl2 với team (OH) bao gồm hóa trị I.
Công thức chất hóa học lớp 8 là tài liệu hữu ích, hỗ trợ công thức tính số Mol, công thức tính nồng độ Mol, cách làm tính mật độ %, phương pháp tính khối lượng, phương pháp tính thể tích dung dịch. Qua đó giúp chúng ta dễ dàng học tập thuộc cách làm để giải nhanh những bài tập hóa học 8. Chúc các bạn học tốt.
Xem thêm:
I. Cách tính nguyên tử khối
NTK của A = cân nặng của nguyên tử A tính bằng gam : cân nặng của 1 đv
C tính ra gam
Ví dụ: NTK của oxi =

II. Định luât bảo toàn khối lượng
Cho phản nghịch ứng: A + B → C + D
Áp dụng định luật pháp BTKL:
m
A + m
B = m
C + m
D
III. Tính công suất phản ứng
- phụ thuộc 1 trong số chất thâm nhập phản ứng:
+ H%= (Lượng thực tế đã sử dụng phản ứng : Lượng tổng số vẫn lấy) x 100%
- phụ thuộc vào 1 trong những chất tạo ra thành
+ H% = (Lượng thực tế thu được : Lượng thu theo lí thuyết) x 100%
IV. Cách làm tính số mol
- n = Số hạt vi tế bào : N
N là hằng số Avogrado: 6,023.1023



P: áp suất (atm)
R: hằng số (22,4: 273)
T: nhiêt đô:

V. Bí quyết tính tỉ khối
- công thức tính tỉ khối của khí A cùng với khí B:

- bí quyết tính tỉ khối của khí A so với không khí:

Trong kia D là khối lượng riêng: D(g/cm3) bao gồm m (g) với V (cm3) xuất xắc ml
VI. Công thức tính thể tích
- Thể tích chất khí nghỉ ngơi đktc: V = n x 22,4
- Thể tích của chất rắn và chất lỏng:

Thể tích ở đk không tiêu chuẩn:

Trong đó:
P: áp suất (atm)
R: hằng số (22,4:273)
T: nhiệt độ độ: o
K (o
C+ 273)
VII. Tính thành phần tỷ lệ về khối lượng
VD: Ax
By ta tính %A, %B

VIII. Nồng độ phần trăm

- trong đó:
+ mct là khối lượng chất tan
+ mdd là trọng lượng dung dịch
-

- trong đó: centimet nồng độ mol (mol/lit)
D cân nặng riêng (g/ml)
M khối lượng mol (g/mol)
IX. Mật độ mol

Trong đó : n
A là số mol
V là thể tích

C%: độ đậm đặc mol
D: khối lượng riêng (g/ml)
M: cân nặng mol (g/mol)
X. Độ tan

CÁC DẠNG BÀI TẬP HÓA 8
DẠNG LẬP CÔNG THỨC HÓA HỌC
I. Lập công thức hóa học tập của hợp chất lúc biết hóa trị
Các cách để khẳng định hóa trị
Bước 1: Viết bí quyết dạng Ax
By
Bước 2: Đặt đẳng thức: x hóa trị của A = y hóa trị của B
Bước 3: biến đổi thành tỉ lệ:

Chọn a’, b’ là phần nhiều số nguyên dương với tỉ lệ b’/a’ là buổi tối giản => x = b (hoặc b’); y = a (hoặc a’)
II. Tính nguyên tố % theo khối lượng của các nguyên tố trong hợp hóa học Ax
By
Cz
Cách 1.
+ Tìm cân nặng mol của hợp chất
+ tìm số mol nguyên tử mỗi nguyên tố trong một mol hợp hóa học rồi quy về khối lượng
+ tra cứu thành phần xác suất các yếu tắc trong thích hợp chất
Cách 2. Xét cách làm hóa học: Ax
By
Cz

Hoặc %C = 100% - (%A + %B)
III. Lập bí quyết hóa học tập của hợp chất lúc biết thành phần xác suất (%) về khối lượng