Bài viết sẽ giới thiệu BẢNG HÓA TRỊ LỚP 8, 9, 10 đầy đủ nhất và phần đông “BÀI CA HÓA TRỊ ” bên dưới dạng các vần thơ vần điều rất dễ dàng học, đó là cách học tập thuộc được những thầy cô và các bạn học sinh hết sức yêu thích. Bài viết này trung trung khu gia sư Đăng Minh sẽ chia sẻ cho các em tất cả về bảng và những cách học giỏi nhất.
Bạn đang xem: 3 cách học thuộc bảng hóa trị lớp 8 nhanh hiệu quả nhất
I. Kiến thức Bảng Hóa Trị Lớp 8
Hầu hết các em học sinh khi lao vào lớp 8 với học môn Hóa Học những được các thầy cô nói tới Bài Ca Hóa Trị lớp 8 đầy đủ. Đây là phương pháp để ghi ghi nhớ bảng hóa trị của các nguyên tố chất hóa học một cách tác dụng nhất. Cùng gia sư Đăng Minh tìm hiểu về Hóa Trị nhé
Bài Ca Hóa Trị đầy đủ này hết sức quan trọng, những em nên học thuộc và hiểu thực chất vì các bài tập Hóa Học liên tiếp phải vận dụng như các bài tập về “Cân bằng hóa học”. Lên lớp 9, 10 – 12 giỏi thi Đại Học, trung học phổ thông đều buộc phải dùng đến. Nó giống như như “Bảng Cửu Chương” với ” bảng chữ cái tiếng Việt ” mà các em đái học buộc phải thuộc suốt những năm học
Nếu các em học sinh muốn học giỏi môn Hóa một cách chắc hẳn rằng nhất cũng rất có thể tham khảo hoặc nhờ bố mẹ tham khảo cách thức tìm gia sư xuất sắc môn Hóa về dạy dỗ kèm trên nhà. Gia sư rất có thể là các anh/chị sinh viên giỏi, học tập trường siêng về Hóa với điểm thi đh môn Hóa cao hoặc là các thầy cô giáo chuyên dạy Hóa. Hãy xem thêm BẢNG GIÁ GIA SƯ để lên chiến lược học tập tốt nhất cho mình nhé.
Các em cũng có thể có thể tìm hiểu thêm rất những kiến thức có lợi tại thể loại CẨM NANG HỌC TẬP cơ mà trung vai trung phong đang xuất bản và chia sẻ nhé.
1. Hóa trị là gì?“Đang ngồi trong lớp nghe giảng -> cây viết rơi xuống -> khom người xuống nhặt bút -> ngửng lên mất cội Hóa” – đó là 1 trong những mẩu chuyện vui mà các bạn học sinh hay truyền tai nhau khi nói đến môn Hóa – một môn học với khoảng độ cạnh tranh hiểu cũng tương tự đòi hỏi phải có sự triệu tập cao độ khi nghe giảng bài.

Chú ý: có những nguyên tố chỉ biểu đạt 1 hóa trị, nhưng cũng đều có những nguyên tố tất cả một vài hóa trị không giống nhau.
2. Bảng hóa trị hóa học của một trong những nguyên giỏi hóa học thường dùng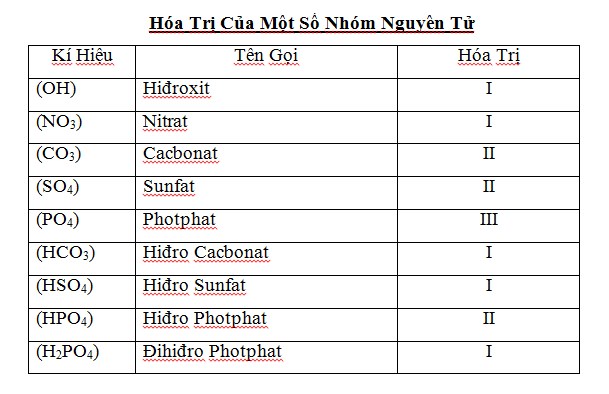
Để học tốt môn Hóa những em cũng hoàn toàn có thể nghĩ đến việc tìm và đào bới gia sư môn Hóa dạy kèm tại nhà giúp mình học tốt hơn nhé.
II. Bài Ca Hóa Trị Lớp 8 Đầu Đủ, dễ dàng Nhớ
Hóa trị là trong số những phần rất đặc biệt quan trọng của môn chất hóa học và việc ghi ghi nhớ hết các hóa trị là một trong việc rất cạnh tranh khăn, đặc biệt quan trọng là chúng ta lớp 8, new chập chững làm quen với cỗ môn Hóa học. Sau đây, công ty chúng tôi sẽ nhắc nhở cho các bạn một mẹo ghi lưu giữ hóa trị rất hấp dẫn giúp cho câu hỏi học và ghi ghi nhớ chúng không hề là vụ việc “nhức nhối”, hãy cùng tham khảo nhé.

Lưu ý : các công thức Hóa Học, Hóa Trị cùng nguyên tử khối của các chất đã theo được áp dụng đến năm lớp 12 nên những em học viên nên nhớ thật kỹ, làm thật nhiều bài tập để ghi nhớ thực chất của con kiến thức.
Ngoài BẢNG HÓA TRỊ thì trong Hóa Học bảng tuần hoàn Hóa Học và vào Toán học tập thì các Công Thức Lượng Giác là kỹ năng mà những em học viên cấp 2, 3 nên học.
III. Quy Tắc Bảng Hóa Trị Và bài xích Tập Ví Dụ
1. Luật lệ hóa trịTrong bí quyết hóa học, tích của chỉ số cùng hóa trị của yếu tố này bởi tích của chỉ số và hóa trị của yếu tắc kia. Gọi cách làm hóa học của bất kỳ hợp hóa học 2 nhân tố là:
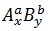
Với:
x, y là chỉ số của mỗi nguyên tố.
a, b là hóa trị của mỗi nguyên tố.
Theo quy tắc hóa trị:
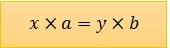
Chuyển thành tỉ lệ:
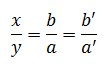
Lấy x = b tuyệt b’ cùng y = a hay a’ (nếu a’ , b’ là các số nguyên dễ dàng và đơn giản hơn đối với a, b).
2. Một trong những dạng bài vận dụng.a. Dạng 1: Tính hóa trị của một nguyên tố.
phương pháp giải:
Dựa vào hóa trị của nguyên tố mang lại trước, tiếp nối áp dụng nguyên tắc hóa trị để tìm được hóa trị còn lại:
x * a = y * b
Bài Tập : Hãy xác định hóa trị của mỗi nguyên tố trong các hợp chất sau đây: KH, H2S, Fe
O, Ag2O, Fe
Cl3 (biết Cl tất cả hóa trị I)
Giải:
Xét hợp hóa học KH:
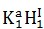
Vì H được chọn làm đơn vị chức năng có hóa trị I
Hóa trị của K là:
Xét hợp hóa học
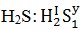
Vì H được chọn làm đơn vị có hóa trị I
Hóa trị của S là:
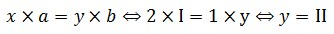
Xét hợp chất Fe
O: (gọi hóa trị của fe là a)
Vì O được lựa chọn làm hai đơn vị có hóa trị II
Hóa trị của fe là:
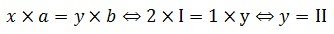
b. Dạng 2: Lập cách làm hóa học của hợp chất theo giá trị.
phương thức giải:
Gọi bí quyết hóa học gồm dạng chung:
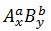
Áp dụng quy tắc hóa trị:
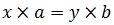
Chuyển thành tỉ lệ:
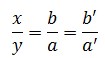
Lấy x = b tuyệt b’ cùng y = a tốt a’ (nếu a’,b’ là phần đa số nguyên dễ dàng và đơn giản hơn đối với a, b).
Hóa trị và electron hóa trị là gì?
Trước đây chúng ta đã nghiên cứu về sự sắp tới xếp của các electron trong các lớp vỏ/quỹ đạo khác nhau. Các electron bao gồm ở lớp vỏ/quỹ đạo ngoại trừ cùng của nguyên tử của một yếu tố được call là những electron hóa trị.
Trong tất cả các phản bội ứng hóa học, chỉ những electron tất cả trong quỹ đạo ngoài cùng bắt đầu tham gia phản ứng. Vì các hạt electron này xuất hiện ở xa phân tử nhân nhất phải lực hút của các hạt nhân lên các electron này là bé dại nhất.
Theo sơ thứ Bohr-Bury, buổi tối đa 8 electron hoàn toàn có thể được cung ứng trong quỹ đạo không tính cùng của nguyên tử. Helium với hydro là nước ngoài lệ bởi chúng chỉ hoàn toàn có thể có hai electron làm việc lớp vỏ của chúng.

Thuật ngữ hóa trị có nghĩa là gì?
Hóa trị là khả năng phối hợp của một phần tử. Nó luôn luôn là một số nguyên. Nó không tồn tại dấu cộng hoặc che dấu trừ. Một electron xuất hiện ở lớp vỏ ngoài của nguyên tử được gọi là “electron hóa trị”. Bạn cũng có thể nói rằng hóa trị là số lượng electron cơ mà một nguyên tố hoàn toàn có thể mất đi hoặc nhận được để đạt được sự ổn định định.
Nói chung, hóa trị được sử dụng để viết cách làm hóa học tập của một hợp chất. Điều này có nghĩa là chúng ta cũng có thể sử dụng hóa trị để biết nguyên tử của một thành phần sẽ link với nguyên tử của yếu tố khác như thế nào.
Ý tưởng
Trong nguyên tử, những electron sắp tới xếp xoay quanh hạt nhân theo phần lớn quỹ đạo (vỏ) không giống nhau. Các quỹ đạo này được biểu diễn dưới dạng K, L, M, N… Nguyên tử của electron hóa trị còn sót lại ở lớp vỏ không tính cùng. Những electron sống lớp vỏ kế bên này thâm nhập vào ngẫu nhiên phản ứng chất hóa học nào bởi chúng thường đựng được nhiều năng lượng hơn những electron có mặt ở các quỹ đạo khác.
Theo quy tắc chén bát tử, quỹ đạo quanh đó cùng của nguyên tử sẽ có thể có buổi tối đa 8 electron nhằm trở cần bền vững. Mặc dù nhiên, nếu như quỹ đạo bên ngoài được tủ đầy, thì đôi lúc rất không nhiều hoặc ko có hoạt động hóa học nào được quan tiếp giáp thấy.
Hóa trị của một nguyên tử
Khái niệm hóa trị phát sinh từ việc nghiên cứu các thành phần trơ. Các nguyên tố trơ còn được gọi là khí hiếm. Chúng bao gồm 8 electron hóa trị (bát tử) trong quỹ đạo/lớp vỏ kế bên cùng, ngoài helium gồm 2 electron (bộ đôi).
Ngoài các nguyên tố này, toàn bộ các thành phần khác đều phải có ít rộng 8 electron trong lớp vỏ hóa trị của chúng.
Để giành được sự ổn định, các nguyên tử này mất, nhấn hoặc chia sẻ electron với các nguyên tử khác để xong bộ tám của chúng. Vày đó, hóa trị của nguyên tử của một nguyên tố có thể được xác minh như sau:
‘Khả năng phối hợp của các nguyên tử của một nguyên tố được call là hóa trị’.
Hoặc là
‘Số lượng electron thu được, mất đi hoặc chia sẻ bởi nguyên tử của một yếu tắc để xong bộ tám (hoặc cỗ đôi) của chính nó để đạt được thông số kỹ thuật ổn định được gọi là hóa trị của nguyên tố’.
Cách tính hóa trị
Để tính hóa trị của một nguyên tố, trước tiên bắt buộc viết cấu hình electron của chính nó rồi mới đo lường và thống kê hóa trị. Hóa trị của một nguyên tố có thể được tính như sau:
Các nguyên tố gồm 1,2,3,4 electron khớp ứng trong lớp vỏ hóa trị của chúng. Đối với những nguyên tố này, hóa trị của chúng ngay số electron tất cả trong lớp vỏ hóa trị của chúng.
Các nguyên tố có khá nhiều hơn 4 electron vào lớp vỏ hóa trị của chúng: Đối với hầu như nguyên tố này có không ít hơn 4 electron vào lớp vỏ hóa trị của chúng, hóa trị hoàn toàn có thể được tính như sau:
Hóa trị = 8 – Số electron hóa trị
Bảng hóa trị những nguyên tố chất hóa học lớp 8 trang 42-43 sgk
Bảng hóa trị lớp 8 trang 42 là 1 phần quan trọng, nó nêu ra hóa trị của 30 yếu tố thường gặp mặt nhất. Được sử dụng ở cả hóa học thcs và THPT.
| Hóa trị của Hydrogen | 1 | 1 |
| Hóa trị của Helium | 2 | 0 |
| Hóa trị của Lithium | 3 | 1 |
| Hóa trị của Beryllium | 4 | 2 |
| Hóa trị của Boron | 5 | 3 |
| Hóa trị của Carbon | 6 | 4 |
| Hóa trị của Nitrogen | 7 | 3 |
| Hóa trị của Oxygen | 8 | 2 |
| Hóa trị của Fluorine | 9 | 1 |
| Hóa trị của Neon | 10 | 0 |
| Hóa trị của Sodium (Na) | 11 | 1 |
| Hóa trị của Magnesium (Mg) | 12 | 2 |
| Hóa trị của Aluminium | 13 | 3 |
| Hóa trị của Silicon | 14 | 4 |
| Hóa trị của Phosphorus | 15 | 3 |
| Hóa trị của Sulphur | 16 | 2 |
| Hóa trị của Chlorine | 17 | 1 |
| Hóa trị của Argon | 18 | 0 |
| Hóa trị của Potassium (K) | 19 | 1 |
| Hóa trị của Calcium | 20 | 2 |
| Hóa trị của Scandium | 21 | 3 |
| Hóa trị của Titanium | 22 | 4 |
| Hóa trị của Vanadium | 23 | 5,4 |
| Hóa trị của Chromium | 24 | 2 |
| Hóa trị của Manganese | 25 | 7, 4, 2 |
| Hóa trị của Iron (Fe) | 26 | 2, 3 |
| Hóa trị của Cobalt | 27 | 3, 2 |
| Hóa trị của Nickel | 28 | 2 |
| Hóa trị của Copper (Cu) | 29 | 2, 1 |
| Hóa trị của Zinc | 30 | 2 |
Cách sử dụng hóa trị
Bảng hóa trị giúp khẳng định có từng nào nguyên tử của một yếu tố kết phù hợp với một nguyên tố khác để tạo thành ngẫu nhiên công thức hóa học nào. Một ứng dụng đặc biệt khác của hóa trị là tìm thấy công thức của những hợp chất.
Nếu chúng ta biết hóa trị của các nguyên tố, bạn có thể nhanh nệm viết công thức của các hợp hóa học này.
Ví dụ:
Công thức của hợp chất cacbon tetraclorua:
Kí hiệu cacbon là C, clo là Cl. Hóa trị của bọn chúng là 4 cùng 1. Phương pháp của hợp hóa học tetraclorua vẫn là CCl4 vì: clo mất một electron với carbon nhận bốn electron để xong bộ tám của nó.
Công thức của hợp chất magie clorua
Ký hiệu của magie clorua là Mg với của clo là Cl. Hóa trị của chúng là 2 cùng 1. Phương pháp của magie clorua là Mg
Cl2 bởi magie mất đi nhì electron và clo thu được một electron để tạo ra thành hợp chất.
Câu hỏi thường gặp gỡ (FAQ)
Tại sao bọn họ cần hóa trị?
Chúng ta bắt buộc hóa trị của một nguyên tố vì nó đưa ra quyết định mức độ mạnh bạo của link giữa các nguyên tử. Hóa trị Y càng tốt thì liên kết càng mạnh. Đó là tại sao tại sao những nguyên tố bao gồm độ bền cao hay được sử dụng trong những phản ứng chất hóa học - chúng tạo ra thành link bền chặt với những nguyên tử khác.
Xem thêm:
Hóa trị tất cả dấu (-,+) không?
Mất electron hoặc tăng electron được điện thoại tư vấn là năng lượng điện nguyên tử, điện tích dương đã đạt được bằng phương pháp tặng một năng lượng điện tử và ngược lại điện tích âm. Bởi vậy, hóa trị không tồn tại dấu cùng oxy hóa bao gồm cả vết dương với âm.